Nach knapp einem Jahr des absoluten Schweigens startete der bereits am 02.12.2010 angekündigte sogenannte „Gorlebendialog“. Am 12. Oktober 2011 wurde ein Fachdialog zu „Gas- und Kohlenwasserstoffvorkommen“ veranstaltet. Jeder war eingeladen, ab dem 14. September Fragen einzureichen, die dann von den Experten diskutiert wurden. Als Experten wurden angekündigt:
- Dr. Guido Bracke – GRS – Gesellschaft für Anlagen- und Reaktorsicherheit,
- Diplom Geologe Ulrich Schneider – Selbständiger Geologe, Büro für Rohstoff- und Umweltgeologie,
- Dr. Jan Richard Weber – BGR – Bundesanstalt für Geowissenschaften und Rohstoffe.
Von Herrn Bracke sind bisher keine einschlägigen Veröffentlichungen bekannt, Herr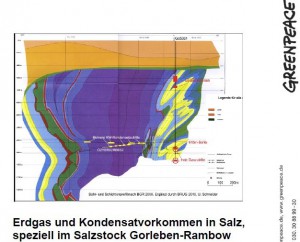 Schneider hat zum Thema die Literaturstudie
Schneider hat zum Thema die Literaturstudie
Erdgas und Kondensatvorkommen in Salz, speziell im Salzstock Gorleben-Rambow
veröffentlicht. Herr Weber war an den beiden folgenden Studien beteiligt:
NOWAK, T., WEBER,J.R. & BORNEMANN, O. (2002): Gas- und Lösungsreservoire im Salzstock Gorleben
Herr Schneider hat sein Angebot zur Beteiligung vor der Veranstaltung zurückgezogen, stattdessen nahm
- Dr. Roland Wyss – Selbständiger Geologe – Dr. Roland Wyss GmbH
teil.
Es blieb im Dunkeln, wer genau Zielgruppe dieser Veranstaltung sein sollte. Ein Bürgerdialog war es offensichtlich nicht, da die wissenschaftlichen Studien in keiner Weise aufbereitet wurden. Sie wurden lediglich zum Download zur Verfügung gestellt.
Erstaunlich war eine Passage im
Schlussstatement der BMU-Staatsekretärin Frau Heiner-Esser ab 2:33:26
Das aller Wichtigste, was heute hier – glaube ich auch – herausgekommen ist, was Herr Siemann auch schon ja angesprochen hat, dass wir hier eine ganze Menge offener Fragen noch zu klären und zu beantworten haben, auch schon zu klären und zu beantworten haben im Rahmen der vorläufigen Sicherheitsanalyse. Es sind Fragen aufgeworfen worden von den Onlinenutzern, denen wir auch noch mal nachgehen müssen, denen wir zum Teil auch bereits nachgehen, wie gerade schon dargestellt wird. Und ich glaube, es ist sehr deutlich geworden, dass Gase und Kohlenwasserstoffe doch ein sehr klares Ausschlusskriterium sind für die Errichtung eines Endlagers.
Die Medien haben verschiedentlich über den ersten „Gorleben-Fachdialog“ berichtet:
Gorlebendialog: Nichts Genaues weiß man nicht
Meinung: Gorlebendialog – Tücken im System
Erneute Kritik an Röttgens „Dialog-Inszenierung“
Wenig Interesse
In der Kritik
„Gorleben-Dialog“ stößt auf wenig Interesse
Der erfolglose Gorleben-Dialog
Gas-Frage bleibt weiterhin nebulös
Hauptsache, nicht bei uns

Hallo,
mein Name ist Dr. Andreas Haeger, ich bin Chemiker und war bis Ende des Jahres 2013 an der Bundesanstalt für Geowissenschaften und Rohstoffe beschäftigt. Ich habe die Beprobung in Gorleben (ich war teilweise unter Tage) mit durchgeführt und habe mit wissenschaftlichen Experimenten zum Kohlenwasserstoff-Projekt beigetragen.
Um es kurz zusammenzufassen: Niemand weiß, wo sich im Salzstock Gorleben wieviel Kohlenwasserstoffe befinden. Die Untersuchungen ergaben starke Schwankungen des Kohlenwasserstoffgehaltes, waren statistisch aber nicht ausreichend. Schon bei der Schachtvorbohrung Gorleben 5001 sind in einer Tiefe von ca. 850 m 5000 Liter „Kondensat“ (vermutlich ein falscher Begriff, gemeint ist Öl) zugetreten. Man muß also damit rechnen, daß sich im Salzstock Gorleben größere Ölvorkommen befinden. Meine Experimente haben ergeben, daß Gorleben-Salz ein ausgezeichneter Cracking-Katalysator für Kohlenwasserstoffe ist. In einem Experiment wurde n-Octan als Modell-Kohlenwasserstoff verwendet. Wir ein Gorleben-Salz mit einer BET-Oberfläche von 30 m2/g als Katalysator verwendet, ergibt sich ein Umsatz zu 100 % zu Methan. Hiermit verachtfacht sich die Molzahl, außerdem ist Methan unter Normalbedigungen gasförmig und n-Octan flüssig. Mit einem starken Druckaufbau muß also unter Einlagerungsbedingungen gerechnet werden.
Zudem konnte ich die Partialoxidation von Kohlenwasserstoffen z.B. zu Ketonen, die Totaloxidation von Kohlenwasserstoffen zu Kohlenstoffdioxid (ergibt mit Wasser Kohlensäure, die z.B. Stahl angreift – es gibt Wasser im Salzstock, einen Laugeneimer habe ich selbst unter Tage gesehen) und die Halogenierung von Kohlenwaserstoffen nachweisen. Das ist naheliegend, da der Salzstock Gorleben im Einlagerungsbereich zu ca. 95 % aus NaCl besteht, was ein Halogenierungsmittel darstellt. Halogenierte Kohlenwasserstoffe sind oft sehr giftig, wie z.B. DDT oder Seveso-Dioxin, die ich jedoch nicht nachweisen konnte. Jedoch können sie entstehen.
Weiterhin muß die Thermochemische Sulfatreduktion beachtet werden. Hierbei reagiert Calcium-Sulfat (CaSO4) mit Kohlenwasserstoffen. Die Kohlenwasserstoffe werden dabei partiell (Aldehyde, Ketone, Oxirane, Carbonsäuren, usw.) oder total (zu Kohlenstoffdioxid und Wasser) oxidiert und das Sulfat (SO42-) wird zu Schwefel-organischen Verbindungen wie Thiolen o.ä, zu Schwefelwasserstoff (hoch giftig) oder zu Schwefel reduziert. Etwa 5 % des Materials im Einlagerungsbereich sind Calcium-Sulfat.
Die an der BGR zur Verfügung stehende Analytik ist unzureichend, um die komplexen chemischen Reaktionen zu erfassen. Es stand nur ein Gaschromatograph mit Flammenionisationsdetektor und einer mit SCD-Sensor zur Verfügung. Verbindungen, die man finden will, müssen vorher in diese Geräte einkalibriert werden, nicht kalibrierte Verbindungen werden nicht gefunden. Am Beginn meiner Arbeiten habe ein einen Gaschromatographen mit Massenspektrometer verlangt, dies ist das für die erforderlichen Arbeiten sinnvolle Analysegerät, da unbekannte Verbindungen erkannt werden, jedoch wurde dies von der BGR nicht umgesetzt. Dennoch sind der Ergebnisse hinreichend, um Gorleben als Atommüll-Endlager sicher auszuschließen. Ich muß weiter darauf hinweisen, daß die an der BGR durchgeführten Experimente in Goldkapseln methodisch schwach sind und aufgrund fehlender Durchmischung nicht geeignet sind, um kinetische Daten zu ermitteln, die zur Vorhersage chemischer Reaktionen notwendig sind. Man hätte zumindest sogenannte „rocking Autoklaven“ verwenden müssen. Die Ergebnisse gelten daher nur qualitativ. An der BGR werden weiterhin Simulationsarbeiten zur Vorhersage der Reaktionskinetik ohne brauchbare kinetische Daten durchgeführt! Die Reaktionssysteme sind zudem so komplex, daß mir eine Simulation aus fachlicher Sicht aussichtslos erscheint, auch weil die Konzentration der Reaktanden im Salzstock Gorleben als Funktion der Ortskoordinaten so gut wie unbekannt sind.
Ich möchte weiterhin darauf hinweisen, daß ich auf der GeoHannover 2012 ein Poster und einen Vortrag von der DBE gesehen bzw. gehört habe, wonach die Asse mit Natronwasserglas stabilisiert werden muß. Verfüllt man ein altes Salzbergwerk nicht, so bricht es irgendwann zusammen. Diese Gefahr besteht vermutlich bei der Asse. Sie sollte daher so schnell wie möglich beräumt werden und nicht erst ab dem Jahr 2030.
Ich möchte weiterhin darauf hinweisen, daß im Salzstock Morsleben Atommüll lagert. Den Zustand von Morsleben kenne ich nicht. Jedoch sind Salzstöcke aus verschiedenen Gründen generell ungeeignete Endlager:
1. Alte Salzbergwerke laufen voll Wasser (saufen ab), wie dies in der Asse der Fall ist, wo täglich ca. 12.000 Liter Wasser hineinlaufen. Salz ist zudem wasserlöslich, besteht ein Wasserkanal, vergrößert er sich sehr wahrscheinlich. Wie z.B. die beiden Schächte von Gorleben sicher abgedichtet werden sollen, so daß kein Wasser eindringt, ist mir vollkommen unklar.
2. Eine Rückholbarkeit ist in Salzstöcken aufgrund der Konvergenz des Salzes nahezu unmöglich. Darunter versteht man die Fließfähigkeit von Salz, so verkleinert sich z.B. ein Gang im Salzstock Gorleben um ca. 2 cm pro Jahr. Nach einigen hundert Jahren gibt es keine Gänge mehr, um den Atommüll zu erreichen. Er liegt dicht umschlossen und ohne Behälter im Salz, da die Behälter nach den bisherigen Planungen nur ca. 500 Jahre halten sollen. Es ist zu bedenken, daß der Atommüll stark wärmeentwickelnd ist und daher auch die Korrosion (v.a. in einem salzig-wäßrigen Umfeld) stark beschleunigt wird. Rückholbarkeit ist wichtig, da es z.B. die Transmutation gibt, hierfür wird in Belgien ein Forschungsreaktor (Myrrha) aufgebaut. Dabei werden radioaktive Nuklide mit langen Halbwertszeiten in solche mit kürzeren Halbwertszeiten umgewandelt. Die notwendige Einlagerungsdauer würde dadurch von ca. einer Million Jahre auf ca. einige tausend Jahre verkürzt. Grundsätzlich muß man sich fragen, ob eine Vorhersage über die Stabilität eines Salzstockes über eine Million Jahre möglich ist, immerhin sollen nach Modellen zwei Eiszeiten in diesem Zeitraum über Europa hinweggehen.
Liebe Grüße
Dr. rer. nat. Andreas Haeger
Hallo,
hier ist noch meine erste Literaturrecherche an der BGR zum Stand des Wissens über Kohlenwasserstoff-Vorkommen in verschiedenen Salzstöcken. Besonders hervorzuheben ist die Tatsache, daß bei der Schachtvorbohrung Go 5001 ca. 5000 Liter „Kondensat“ (wohl Öl) zugetreten sind. Die Untersuchungen zum Kohlenwasserstoffgehalt in den beiden Querschlägen aus den Jahren 2011 bis 2013 sind von daher bereits statistisch nicht signifikant. Ein weitaus engeres Raster hätte gelegt werden müssen.
3. 1 Überblick zu Kohlenwasserstoffen in Salzgestein
3.1.1 Auftreten von Kohlenwasserstoffen und Permanentgasen in Salzgestein
KOVALEVICH et al. (2008) haben Fluideinschlüsse in Evaporiten auf Gase und Kohlenwasserstoffe hin untersucht, die einem Ölvorkommen überlagert sind (Westpolen) und mit Evaporitproben verglichen, die keinem Ölvorkommen überlagert sind (Nordpolen). Die Analyse der organischen Verbindungen erfolgte durch Gaschromatographie und Massenspektrometrie.
PIRONON et al. (1995a) haben Fluideinschlüsse in Evaporitproben aus dem Etrez-Gebiet und dem Cormoz-Gebiet des Bresse-Beckens (Frankreich) mittels FTIR-Mikrospektroskopie untersucht. In den Einschlüssen konnten diese Autoren Sole, feste organische Bestandteile, eine flüssige organische Phase und eine Gasphase nachweisen. Im Etrez-Gebiet dominiert Sole in den Einschlüssen, daneben fanden sie amorphes organisches Material und einen kleinen Anteil aliphatischer Kohlenwasserstoffe. Diese Zusammensetzung weist auf unreifes organisches Material hin. Im Cormoz-Gebiet haben diese Autoren daneben auch Einschlüsse mit einem hohen Anteil organischen Materials gefunden. Dieses besteht vorwiegend aus leichten Aliphaten (~ C5), mittleren Aliphaten (~ C7), Öl (> C7), partiell oxidierten Aromaten und Aminosäuren. Die Gasphase besteht aus CO2, Methan wurde nicht gefunden.
Öl einer höheren Reife haben PIRONON et al. (1995b) in Einschlüssen in einem Salzstock in Gabun nachgewiesen. Diese Autoren unterteilen die Einschlüsse in zwei Typen. Einschlüsse des ersten Typs bestehen aus Öl und Gas in variabler Zusammensetzung und sind frei von sichtbarer Sole. Die Gasphase enthält CH4, CO2 und Alkane, jedoch kein N2 und kein H2S. Die Ölphase besteht aus einem leichten bis mittleren Öl und fluoresziert, was auf Aromaten hinweist. Die mittlere Kettenlänge der Alkane beträgt in gasreichen Einschlüssen ~ C6, in ölreichen Einschlüssen > C7. Einschlüsse des zweiten Typs befinden sich auf Korngrenzen, sie bestehen aus einer Öl- und einer Solephase und beinhalten kein Gas. Die Ölphase besteht überwiegend aus leichten Alkanen und wenig Aromaten. Nach Ansicht dieser Autoren wurden diese Einschlüsse durch Migration von Ölbestandteilen bei Temperaturen bis 60°C gebildet.
In einer Salzlagerstätte in Ostsibirien konnten GRISHINA et al. (1998) verschiedene Typen von Fluideinschlüssen nachweisen. Die organischen Bestandteile wurden mit Raman-Spektroskopie und FTIR-Mikrospektroskopie untersucht. Diese Autoren identifizierten reine Gaseinschlüsse, die überwiegend aus N2 oder CH4 bzw. Mischungen aus beiden bestehen, weiterhin Öleinschlüsse von aliphatischen und aromatischen Kohlenwasserstoffen und schließlich Einschlüsse, die Kohlenwasserstoffe und Stickstoff beinhalten, sowie solche mit einer Kohlenwasserstoff- und einer Solephase. CO2 und H2S wurden von diesen Autoren nur in Gebieten nachgewiesen, in denen Magma eingedrungen ist. Weiterhin wurde auch festes, kohleartiges Material in Einschlüssen gefunden. Öl und Methan haben diese Autoren vermehrt in Einschlüssen im Bereich des Kalisalzes und weniger im Bereich des Steinsalzes gefunden. Intrakristalline mehrphasige Fluideinschlüsse aus Sole und Öl wurden ebenso nachgewiesen, wie von PIRONON et al. (1995b) in Gabun.
SHANINA et al. (2000) identifizierten in Salzproben der der Verkhnyaya Kama Salzablagerung Einschlüsse mit farbigen öligen und paraffinartigen Substanzen, Einschlüsse mit Bitumenkügelchen und farblosen Kohlenwasserstoffen und solche, die einen gelblichen oder braunen Film um den Einschluß aufweisen, der luminesziert. Die Fluideinschlüsse enthalten auch Gas, welches jedoch von diesen Autoren nicht charakterisiert wurde.
Die Freisetzung von Gasen ist im Kalibergbau ein lange bekanntes Problem. GROPP (1919) berichtet von 106 Gasfreisetzungen in deutschen Kalibergwerken zwischen 1907 und 1917. Oft befänden sich die Gase am Übergang zwischen Steinsalz und Carnallit und Grubengasausbrüche beträchtlichen Umfangs seien oft an den Anhydrit gebunden. Nach Gropp wurde häufig berichtet, daß bei Gausaustritten ein petroleumartiger Geruch auftritt. In einigen Fällen sei auch Erdöl in beträchtlichen Mengen mit Gasen zusammen aufgetreten.
Auch HEMPEL (1974) berichtet über das Auftreten brennbarer Gase in Kaligruben. Nach schweren Explosionen wurden in der DDR alle das Kaliflöz Staßfurt bauenden Gruben zu Schlagwettergruben erklärt. Die Gase wurden als Bläser, durch plötzliche Ausbrüche von Salzgestein und durch Ausgasung des Gesteins freigesetzt.
MÜLLER et al. (1956) haben den Gesamtgasgehalt und den Gehalt an gasförmigen Kohlenwasserstoffen in Kaligruben der DDR untersucht. Hierfür kam eine von den Autoren selbst entwickelte Apparatur zum Einsatz. In dieser wurden die Salzproben aufgelöst und das freigesetzte Gas in einer Bürette aufgefangen.
SCHRADER et al. [Schrader 1960] kritisieren den Versuchsaufbau von Müller et al., da bei diesem Aufbau die Löslichkeit der Gase in Wasser, einer organischen Sperrflüssigkeit (CCl4) und die Volumenkontraktion beim Auflösen des Salzes Fehler verursachen. Um diese Probleme zu vermeiden, entwickelten Schrader et al. die sog. „Umlösemethode“ (Salzgasvolumeter), um den Gasgehalt von Salzproben verschiedener Kaligruben der DDR zu bestimmen. Dabei wird das Gas durch eine kleine Lösungsmittelmenge freigesetzt, die durch Verdampfen und Kondensation im Kreislauf geführt wird.
KNABE (1989) hat den Gehalt an gesteinsgebundenen Gasen im Salinar (Zechstein) untersucht. Hierfür wurden Proben grob auf 10 mm bis 15 mm Korngröße vorzerkleinert und in einer Scheibenschwingmühle gemahlen, wobei eine Argon-Atmosphäre vor dem Mahlvorgang durch Evakuieren und Spülen mit Argon hergestellt wurde. Nach dem Mahlvorgang wurden Gasproben genommen und gaschromatographisch untersucht. Knabe weist jedoch darauf hin, daß bei diesem Verfahren 50 % bis 60 % der gesteinsgebundenen Gase in Mikroporen verbleiben und nicht erfaßt werden, wie Vergleichsmessungen mit der Umlösemethode, siehe SCHRADER (1960), ergaben.
GERLING et al. (1988) haben Kohlenwasserstoffgehalte und deren Kohlenstoff- sowie Wasserstoff-Isotopenverhältnisse an Proben aus dem Salzstock Gorleben bestimmt. Die Salzproben wurden auf gasförmige Kohlenwasserstoffe von C1 bis C4 untersucht. Hierzu wurden 300 g Salz unter Vakuum in destilliertem Wasser gelöst. Die Lösung wurde anschließend zum Sieden gebracht und die freigesetzten Gase in evakuierten Probengefäßen aufgefangen. Die Analyse erfolgte durch GC/irMS.
In einer weiteren Untersuchung haben GERLING et al. (1991) Kohlenwasserstoffgehalte (C1 bis C5) und deren Kohlenstoff- sowie Wasserstoff-Isotopenverhältnisse an Zechsteinevaporiten in Norddeutschland bestimmt. Der Schwerpunkt liegt dabei auf dem Salzstock Gorleben. Die Probenaufbereitung und Analytik erfolgte analog GERLING et al. (1988).
Die Zusammensetzung intrakristallin und interkristallin gebundener Gase im Zechstein 2 in Zielitz wurde von SIEMANN (2007) und POTTER et al. (2004) untersucht. Um interkristallin gebundene Gase zu erfassen, wurden die Proben in gasdichten Beuteln verschweißt und im Beutel mit einer Gesteinsquetsche zerdrückt. Die Gasproben wurden mit einer Spritze durch ein Septum entnommen. Um das Gesamtgas zu erfassen, wurden die Proben in Wasser gelöst und die im Headspace angesammelten Gase analysiert. Die Analyse erfolgt mittels GC/irMS.
Über die Ergebnisse von in-situ-Untersuchungen zur Gasfreisetzung im Salzbergwerk Asse berichtet JOCKWER (1997). Für diese Experimente wurden Bohrlöcher mit Packern gasdicht verschlossen. Nach etwa 1 – 3 Jahren stellte sich in den Bohrlöchern ein stationärer Zustand ein, wobei sich die Gaskonzentration selbst in wenigen Metern voneinander entfernten Bohrlöchern sehr stark unterschied.
3.1.2 Herkunft von Kohlenwasserstoffen in Salzgestein
KOVALEVICH et al. (2008) gelangen zur Schlußfolgerung, daß die Kohlenwasserstoffe durch Migration aus dem Muttergestein ins Salz gelangt sind, wobei sich die Zusammensetzung der Kohlenwasserstoffe verändert habe. Das 13C/12C-Isotopenverhältnis, ausgedrückt in der Relation gegenüber dem Standard PDB (Pee Dee Belemnite), siehe Gl. (1)
[‰] (1)
liegt für alle Kohlenwasserstoffe nahe bei 13C = -29 ‰. Durch den Vergleich des 13C/12C-Isotopenverhältnisses mit Ölproben aus dem liegenden Hauptdolomit leiten diese Autoren ab, daß das Bitumen im Steinsalz denselben Ursprung hat, wenngleich die Korrelation des 13C/12C-Isotopenverhältnisses mit Kerogen im Salz auch den Möglichkeit zulasse, daß das Bitumen im Salz entstanden sei.
PIRONON et al. (1995a) gehen davon aus, daß die organischen Materialien in situ im Salz gebildet wurden. Einschlüsse auf Korngrenzen zeigen eine höhere Reife des organischen Materials und sind frei von Gas und festen organischen Bestandteilen. Sie sind nach Ansicht der Autoren durch Migration von Bestandteilen aus unreifem Öl entstanden, welches im Salz gebildet wurde.
Die Frage, ob organische Verbindungen im Salzgestein durch Migration aus dem darunterliegenden Muttergestein ins Salz gelangt sind oder in situ im Salz entstanden sind, wird von SHANINA et al. (2000) am Beispiel der Verkhnyaya Kama Salzablagerung diskutiert.
Anhand von Biomarkern gelangen diese Autoren zu der Schlußfolgerung, daß das organische Material nicht durch Migration aus darunterliegenden Öl- und Gasfeldern ins Salz gelangt ist, sondern im Salz aus marinem Phytoplankton gebildet wurde.
Die Migration von Öl im Bereich der Korngrenzen von Steinsalz wird von SCHOENHERR et al. (2007) zur Deutung von Bitumeneinschlüssen in einem Salzstock des Ara-Salzes in Oman herangezogen. Dieser Salzstock umschließt vollständig ein ölhaltiges Karbonat-Muttergestein. Das Salz ist dunkel gefärbt und enthält im Bereich der Korngrenzen Bitumen. Schoenherr et al. postulieren aufgrund ihrer elektronenmikroskopischen Untersuchungen, daß Öl in die Korngrenzen des Salzstocks eindringt, wenn der Öldruck größer ist, als der Druck der Sole im Salz und der Kapillardruck. Durch eindringendes Öl wird das Steinsalz aufgeweitet und für Öl permeabel. Anschließend werde das Öl in Bitumen umgewandelt, wobei Gas freigesetzt werde. Allerdings konnten Schoenherr et al. bisher kein Gas nachweisen.
Die Fragestellung, ob Evaporite als Muttergestein für die Ölbildung angesehen werden können, wird von SONNENFELD (1985) diskutiert. Nach Sonnenfeld liegt ein starker Konzentrationsgradient an Sauerstoff und Salz in Verdunstungsbecken vor. Die Biomasseproduktion in oberflächennahem Wasser von Verdunstungsbecken ist hoch. Diese Biomasse sinkt zu Boden. Das Wasser am Boden ist salzreich und arm an Sauerstoff. Aufgrund des hohen osmotischen Drucks überleben in dieser Zone nur Blaualgen und anaerobe Bakterien. Zu Boden gesunkene Biomasse wird anaerob zersetzt und die organischen Rückstände reichern sich in den Evaporiten an.
GERLING et al. (1988) haben Kohlenstoff- sowie Wasserstoff-Isotopenverhältnisse an Proben aus dem Salzstock Gorleben bestimmt. Die 13C-Werte weisen eine ungewöhnlich breite Streuung auf. Im Steinsalz liegt der 13C-Wert zwischen – 41,5 ‰ und – 35,1 ‰, während im Kalisalz Werte bis zu + 10,7 ‰ (bei Mittelwerten zwischen – 27,9 ‰ und – 8,9 ‰) gefunden wurden. Die außergewöhnliche Anreicherung von 13C in den Kohlenwasserstoffen des Kalisalzes wird von diesen Autoren nicht abschließend gedeutet.
In einer weiteren Untersuchung haben GERLING et al. (1991) die Kohlenstoff- sowie Wasserstoff-Isotopenverhältnisse an Zechsteinevaporiten in Norddeutschland bestimmt. Der Schwerpunkt liegt dabei auf dem Salzstock Gorleben. In Steinsalzen, Anhydriten, carnallitischen Kluftfüllungen und Tonstein liegt der 13C1-Wert zwischen – 41,5 ‰ und – 35,1 ‰, während im Kalisalz Werte zwischen -27,9 ‰ und +12,7 ‰ gefunden wurden. Vergleichbare Daten haben diese Autoren für die 13C2-Werte gefunden. Während das 12C/13C-Isotopenverhältnis der Gase in Steinsalzen, Anhydriten, carnallitischen Kluftfüllungen und Tonstein im Bereich thermisch gebildeter Kohlenwasserstoffe liegt, wurde die starke Anreicherung mit 13C im Gas aus den Kaliflözen von den Autoren nicht gedeutet. Mittels organisch-geochemischer Untersuchungen gelangen Gerling et al. zu der Schlussfolgerung, daß organische Substanz des Kupferschiefer das Muttergestein für die thermisch gebildeten gasförmigen (und flüssigen) Kohlenwasserstoffe im Salzstock Gorleben ist.
Die Zusammensetzung intrakristallin und interkristallin gebundener Gase im Zechstein 2 in Zielitz wurde von SIEMANN (2007) und POTTER et al. (2004) untersucht. Das 13C/12C-Verhältnis des intrakristallin gebundenen Methans steigt dabei von 13C = – 45 ‰ bis – 50 ‰ im basalen Teil des Steinsalzes auf ungewöhnlich 13C-angereicherte Werte von bis zu + 21 ‰ im oberen Bereich des untersuchten Horizonts. Ähnlich verlaufen die 13C-Werte für primäre innerkristalline Einschlüsse, während der 13C-Wert für sekundäre, auf Spaltrissen liegende Einschlüsse konstant um – 25 ‰ beträgt. Zur Deutung der ungewöhnlichen 13C-Anreicherung nehmen Siemann und Potter et al. an, daß mit zunehmender Eindunstung leichtes CO2 im Meerwasser abgereichert wurde und das schwerer werdende CO2 von methanogenen Bakterien zu CH4 umgesetzt wurde.
3.1.3 Gehalte an Kohlenwasserstoffen in Salzgestein
Im Steinsalz aus Westpolen sind nach KOVALEVICH et al. (2008) 0,23 m3/t bis 15,6 m3/t Gesamtgas enthalten, im Durchschnitt 5,13 m3/t. Neben Gas enthalten die Einschlüsse Sole und Bitumenkügelchen. Die Gase enthalten 51,5 – 95,2 Vol.-% CH4, bis zu 35,7 Vol.-% N2, bis zu 28,2 Vol.-% CO2 und 0,2 – 4,8 Vol.-% H2. Im Steinsalz aus Nordpolen sind 3,36 m3/t bis 7,78 m3/t Gesamtgas enthalten, im Durchschnitt 4,85 m3/t. Neben dem Gas enthalten die Einschlüsse Sole, aber keine Bitumenkügelchen. Das Gas besteht überwiegend aus N2 (56,0 – 97,3 Vol.-%) und kleineren Mengen an CH4, CO2 und H2. Aus den Daten von Kovalevich errechnet sich ein Methangehalt für Salzproben aus Westpolen zwischen 0,13 m3/t und 13,5 m3/t, im Durchschnitt 4,47 m3/t. In den Proben aus Nordpolen liegt der Methangehalt zwischen 0,06 m3/t und 2,5 m3/t, im Durchschnitt 1,13 m3/t.
In den Bitumenkügelchen aus dem Steinsalz dominieren gesättigte Kohlenwasserstoffe, bei Bitumenkügelchen aus Anhydrit ist dies ebenso, jedoch haben diese Autoren auch bis zu 33 Gew.-% Aromaten gefunden.
Um den Gehalt an organischem Kohlenstoff zu bestimmen, haben SHANINA et al. (2000) Salzproben der Verkhnyaya Kama Salzablagerung in Wasser gelöst und die organischen Moleküle mit Chloroform extrahiert. Die Analyse erfolgte durch Gaschromatographie/Massenspektrometrie. Der Gehalt an organischem Kohlenstoff beträgt nach diesen Autoren 0,11 % bis 0,26 %.
SCHOENHERR et al. (2007) fanden in einem Salzstock des Ara-Salzes in Oman Bitumeneinschlüsse .Das Salz ist dunkel gefärbt und enthält im Bereich der Korngrenzen Bitumen mit einem Anteil von 1,2 Gew.-%.
GROPP (1919) beschreibt 106 Gasfreisetzungen in deutschen Kalibergwerken zwischen 1907 und 1917. Der überwiegende Teil bestand gemäß Gropp aus Mischungen aus Kohlenwasserstoffen und Stickstoff, wobei Methan die Kohlenwasserstoffe mengenmäßig dominiert. Der Methangehalt liegt im Durchschnitt bei 10 % bis 20 %, jedoch wurden auch Methangehalte bis 85 % beobachtet. Daneben wurden auch Wasserstoff, Wasserstoff/Stickstoffmischungen, Stickstoff, H2S und CO2 freigesetzt.
Auch HEMPEL (1974) berichtet über das Auftreten brennbarer Gase in Kaligruben. Die Hauptbestandteile der Gase sind nach Hempel Methan (5 Vol.-% bis 60 Vol.-%), Stickstoff (15 Vol.-% bis 90 Vol.-%) und CO2, daneben treten Ethan und Wasserstoff in erheblichen Mengen auf. Aufgrund von CH4-Messungen im Hauptausziehstrom bestimmte Hempel einen CH4-Gehalt der Gruben im Südharz zwischen 0,1 m3/t bis 0,3 m3/t und im Saale-Unstrut-Revier auf maximal 0,05 m3/t. Hempel geht davon aus, daß die Kohlenwasserstoffe im Salz gebildet wurden.
Im Steinsalz von Kaligruben der DDR fanden MÜLLER et al. (1956) 100 – 160 cm3/kg Gesamtgase. An gasförmigen Kohlenwasserstoffen sind im Steinsalz zwischen 0 cm3/kg und 84 cm3/kg enthalten, überwiegend Methan, aber auch Ethan und geringe Mengen höherer Kohlenwasserstoffe.
SCHRADER et al. (1960) bestimmten Gesamtgasgehalte in Proben verschiedener Kaligruben der DDR zwischen 2,9 ml und 59,2 ml. Leider gibt es keine Angaben zur Gesteinsmasse, auf die sich diese Werte beziehen. Der Kohlenwasserstoffgehalt wurde von diesen Autoren nicht bestimmt.
KNABE (1989) hat den Gehalt an gesteinsgebundenen Gasen im Salinar (Zechstein) untersucht. Im Steinsalz fand Knabe zwischen 5 cm3/t und 384 cm3/t Gesamtkohlenwasserstoff.
FREYER (1978) hat an Proben der Werra-Folge des deutschen Zechsteins den Gesamtkohlenstoffgehalt, den anorganischen Kohlenstoffgehalt und den Methangehalt bestimmt. Zur Bestimmung des Gesamtkohlenstoffgehalts wurden gemahlene Evaporitproben mit CuO als Katalysator in einem Sauerstoffstrom verbrannt und die Menge des entstandenen CO2 bestimmt. Der Gesamtkohlenstoffgehalt klarer Evaporitproben beträgt 10 ppm bis 80 ppm [gTOC/gGestein*106], wobei es sich zu etwa 90 % um organischen Kohlenstoff handelt. Das Kohlenstoff-Isotopenverhältnis liegt für den organischen Kohlenstoff bei 13C-Werten zwischen -20,3 ‰ und -26,6 ‰. Der Autor geht davon aus, daß der organische Kohlenstoff direkt aus dem Meerwasser stammt. Meerwasser mit 1 mg gelöstem Kohlenstoff pro Liter sollte nach Angaben des Autors zu einem Rückstand im Sediment von 30 ppm führen, wenn der gesamte Kohlenstoff mit abgelagert wird.
Zur Bestimmung des Methangehaltes wurden 100 g frisch zerkleinerter Evaporit in 300 ml mit He entgastem Wasser gelöst. Das Methan wurde mit He (25 ml/min) ausgespült und in einer Kühlfalle (Flüssigstickstoff) gesammelt. Wasser wurde in einer vorgeschalteten Kühlfalle (Trockeneis + Aceton) entfernt. Die Methanbestimmung erfolgte über GC/FID. Der Methangehalt der Proben lag zwischen 0,3 µl/100g und 7,8 µl/100g Evaporitgestein. Neben Methan und Kohlenstoff hat Freyer auch Schwefel und H2S bestimmt, die nach Angabe des Autors aus der Reduktion von Sulfaten stammen.
GERLING et al. (1988) haben Kohlenwasserstoffgehalte an Proben aus dem Salzstock Gorleben bestimmt. Es wurden Gesamtmengen an gasförmigen Kohlenwasserstoffen zwischen 488 µmol/kg und 80012 µmol/kg festgestellt, im Mittel sind es 12225 µmol/kg. Diese Autoren weisen jedoch auf den langen Lagerzeitraum hin, der zu einem Verlust an interkristallin gebundenem Gas geführt haben könne.
In einer weiteren Untersuchung haben GERLING et al. (1991) Kohlenwasserstoffgehalte (C1 bis C5) an Zechsteinevaporiten in Norddeutschland bestimmt. Der Schwerpunkt liegt dabei auf dem Salzstock Gorleben. Diese Autoren identifizierten Methan als den dominierenden Kohlenwasserstoff, der in Kaliflözen mit 0,6 l/m3 bis 1,1 l/m3 vorkommt. Im Steinsalz liegt der Methangehalt dagegen bei unter 0,2 l/m3. Die Kohlenwasserstoffgehalte der einzelnen Proben sind ausführlich tabellarisch dargestellt.
Die Zusammensetzung intrakristallin und interkristallin gebundener Gase im Zechstein 2 in Zielitz wurde von SIEMANN (2007) und POTTER et al. (2004) untersucht. Die Gaszusammensetzungen schwanken nach den Ergebnissen dieser Autoren von Einschluß zu Einschluß und auch vom Liegenden zum Hangenden. Im obersten Abschnitt der Steinsalzabfolge fand Siemann N2 von 0 – 42 mol-%, CH4 von 9 – 53 mol-% und H2 von 8 – 89 mol-%. Im Bereich der basalen Halite fand dieser Autor Einschlüsse, die in der Regel Öl und CH4 aufwiesen.
Über die Ergebnisse von in-situ-Untersuchungen zur Gasfreisetzung im Salzbergwerk Asse berichtet Jockwer [Jockwer 1997]. Als maximale Konzentration in gasdichten Bohrlöchern ermittelte Jockwer bis zu 300 ppm (cm3/m3) Methan und bis zu 100 ppm höhere Kohlenwasserstoffe. Neben Kohlenwasserstoffen quantifizierte Jockwer CO2, H2, HCl, H2S, SO2, H2O, CO und Cl2. Zusätzlich wurden Analysen zur Bestimmung von Gaskomponenten in der Förderluft durchgeführt. Nach deren Ergebnis ergab sich für das Salzgestein im Bergwerk Asse ein durchschnittlicher Methangehalt von 100 l/m3. Zwischen dem Gehalt an brennbaren Gasen und der mineralogischen Zusammensetzung besteht nach Jockwer kein Zusammenhang.
Tabelle 1: Kohlenwasserstoffgehalte in Evaporiten:
Autor Analyt min. [ppm] max. [ppm] Mittelwert [ppm]
Kovalevich 2008 Methan 405 96163 22398
Schoenherr 2007 Bitumen 12000
Shanina 2000 TOC 1100 2600
Gerling 1988
Gorleben CH4 – C4H10 0,19 4,1 2,2
Gerling 1991
Gorleben CH4 – C5H12 0,007 1,83 0,55
Gerling 1991
weitere Gruben CH4 – C5H12 0,002 2,51 0,66
Freyer 1978 TOC 13,5 56,1 34,44
Freyer 1978 CH4 0,002 0,055 0,019
Hempel 1974 CH4 (Wetter) 36 214 107
Knabe 1989 Gesamt-KW 0,004
(berechnet als CH4) 0,27
(berechnet als CH4) 0,04
(berechnet als CH4)
Müller 1956
Südharzrevier CH4, C2H6
und höhere 70 78 74
Müller 1956
Werrarevier CH4, C2H6
und höhere 0 3 1,5
Jockwer 1997
Asse CH4 (Wetter) 30
3.2 Überblick zu Vorarbeiten zu Kohlenwasserstoffen im Salzstock Gorleben
3.2.1 Auftreten von Kohlenwasserstoffen und Permanentgasen im Salzstock Gorleben
Beim Abteufen von Bohrungen im Salzstock Gorleben sind flüssige und gasförmige Kohlenwasserstoffe zugetreten. In der Schachtvorbohrung Go 5001 trat Gas zu, das ca. 36 m3 Bohrspülung ausförderte. Daneben traten knapp 5 m3 Kohlenwasserstoffe zu. Die Zutritte in der Schachtvorbohrung Go 5002 waren gering, siehe GRÜBLER (1984).
Beim Stoßen einiger Erkundungsbohrungen und beim Auffahren der Querschläge 1 Ost und 1 West kam es bereichsweise zu Zutritten von flüssigen Kohlenwasserstoffen. Diese sind durch sichtbare Feuchtstellen und einen intensiven Kohlenwasserstoffgeruch charakterisiert. Auch noch Monate nach dem Auffahren der Strecken wurden neue Feuchtstellen festgestellt, die sich infolge der Konvergenz und der Auflockerung des Gesteins um die Strecke herum gebildet haben. Die Vorkommen liegen vorwiegend im Knäuelsalz (z2HS1). Weitere Vorkommen außerhalb des Knäuelsalzes sind ein Vorkommen am Bohrort 1.2, ein Vorkommen im Querschlag 1 West im jüngeren Streifensalz, zwei Vorkommen im Bohrort 3 im Streifensalz und ein Vorkommen im Querschlag 1 Ost im Streifensalz, siehe BORNEMANN (2001). Zur besseren Kenntnis der Verteilung der Kohlenwasserstoffvorkommen wurde zusätzlich zur normalen geologischen Kartierung eine Kartierung unter UV-Strahlung vorgenommen. Aromatische Kohlenwasserstoffe fluoreszieren unter UV-Strahlung. Die Auswertung der UV-Kartierung ergab für die Lage der Kohlenwasserstoffvorkommen, daß die Verteilung der Kohlenwasserstoffvorkommen unregelmäßig ist und Gesetzmäßigkeiten bezüglich der Lage zur Gesamtstruktur des Hauptsalzsattels nicht erkennbar sind. Die einzelnen Vorkommen sind isoliert und weisen keine Verbindung untereinander auf. Sie sind bei länglicher bandartiger Erstreckung annähernd in der Schichtung ausgerichtet oder verlaufen dazu spitzwinklig. Sie treten in diffus wolkigen Formen mit unscharfen Übergängen zu kohlenwasserstofffreien Bereichen auf, in bandartig dezimeterbreiten Lagen mit scharfem Übergang zu kohlenwasserstofffreien Bereichen, in Resten von Kleinfalten, die durch diffus verteilte Kohlenwasserstoffvorkommen abgebildet werden und in eckigen Brocken mit scharfer Begrenzung zu kohlenwasserstofffreiem Steinsalz, siehe BORNEMANN (2001).
Neben den Feuchtstellen wurden im Salzstock Gorleben wiederholt flüssige Kohlenwasserstoffe angetroffen.
Mittels Laser-Raman-Spektroskopie hat PROHL (1998) gasführende Einschlüsse des Salzstocks Gorleben untersucht. Prohl fand Einschlüsse, die lediglich N2 führen, die N2 und O2 beinhalten, in denen neben N2 und O2 Methan vorliegt, die N2, Methan und Ethan führen, die Methan, Ethan N2 und H2 führen, die N2, Methan und H2S beinhalten und solche, die abgesehen von O2 alle aufgeführten Gase aufweisen. In unmittelbarer Nachbarschaft fand Prohl lösungsfreie Einschlüsse, die nur Methan führen, Einschlüsse, in denen ein N2/Methan-Gemisch neben H2O vorliegt und solche, die lediglich Lösung und damit verbunden H2O in der Gasphase enthalten. Aus diesen Beobachtungen schließt Prohl, daß in der Vergangenheit eine erhebliche Mobilisierung von gasförmigen Komponenten stattgefunden hat. Einen Zusammenhang zwischen der Gaszusammensetzung und den untersuchten Horizonten besteht laut Prohl nicht, die Herkunft der Gase konnte nicht geklärt werden. Dieser Autor geht davon aus, daß der gefundene Wasserstoff seit Bildung der Einschlüsse in diesen vorliegt. Da H2 nicht durch Diffusion abgeführt wird, stellt sich laut Prohl die Frage, ob bei der Korrosion von Metallbehältern für die Lagerung radioaktiver Abfälle entstehender Wasserstoff zu einem Aufbrechen der Salzformation führen kann.
3.2.2 Herkunft von Kohlenwasserstoffen im Salzstock Gorleben
3.2.2.1 Genetische Typisierung gasförmiger Kohlenwasserstoffe
Einleitung
Neben einer Quantifizierung haben Faber und Gerling, siehe FABER (2001) und FABER (2002), auch eine genetische Typisierung der Kohlenwasserstoffe unternommen, um ihre Herkunft zu bestimmen. Zur Bestimmung der Kohlenstoff- sowie Wasserstoff-Isotopenverhältnisse wurden zwei unterschiedliche Verfahren eingesetzt:
Bei größeren Gasmengen wurden die Komponenten mittels präparativer Gas-chromatographie separiert, die Kohlenwasserstoffe einzeln in getrennten Verbrennungsöfen oxidiert und das jeweils entstehende CO2 für die anschließende massenspektrometrische Bestimmung der 13C/12C-Isotopenverhältnisse aufgefangen. Das Original-CO2 der Gase wurde unmittelbar nach der Separation aufgefangen. Das im Verbrennungs¬ofen ebenfalls entstehende Oxidationswasser wurde zur Bestimmung der D/H-Isotopenverhältnisse (mittels Zink) zu H2 reduziert, siehe Faber (2001).
Die Bestimmung der Kohlenstoff-Isotopenverhältnisse an kleinen Gasmengen, wie sie z.B. bei den meisten der salzgebundenen Gasen vorlagen, erfolgte per online-Kopplung eines Gaschromatographen mit einem Verbrennungsofen und einem Massenspektrometer. Etwa 2-4 ml Gas werden dazu in einen Gas¬chromatographen injiziert und per Kühlfalle mit flüssigem N2 auf der Säule fokussiert. Nach Trennung der Gaskomponenten auf der Säule und anschließender Verbrennung des Methans (und Ethans) in dem angeflanschten Oxidationsofen zu CO2 wird dieses Gas unmittelbar in ein Massenspektrometer geleitet, in dem das 13C/12C-Verhältnis gemessen wird, siehe FABER (2001).
Das 13C/12C-Isotopenverhältnis wird ausgedrückt in der Relation gegenüber dem Standard PDB (Pee Dee Belemnite), siehe Gl. (1). In analoger Weise wird das 2H/1H -Isotopenverhältnis D ausgedrückt in Relation gegenüber dem Standard SMOW (Standard Mean Ocean Water).
Wird der 13C-Wert von Methan als Funktion des D-Wertes von Methan aufgetragen, spricht man von einem sogenannten „CD-Diagramm“, siehe SCHOELL (1980) und SCHOELL (1984). Dies ermöglicht eine Differenzierung zwischen bakteriell und thermisch gebildetem Methan und zwischen Methan aus sapropelitischem und terrigenem Muttergestein.
Wird das Verhältnis Methan/(Ethan+Propan) als Funktion des 13C-Wertes von Methan aufgetragen, spricht man von einem sogenannten „Bernard-Diagramm“, siehe BERNARD (1976). Dies ermöglicht eine Differenzierung zwischen thermisch und mikrobiell generierten Kohlenwasserstoffen.
Aufgrund der größeren Gasmengen übertrifft die Datenqualität der frei zugetretenen Gase aus dem Salzstock Gorleben jene der salzgebundenen Gase und der Headspace-Gase, siehe FABER (2002). Die isotopengeochemischen Ergebnisse der Headspace-Gase werden aufgrund von Problemen bei der Probenahme, wie undichten Behältern, in diesem Bericht nicht zusammengefaßt.
Freie Gase
Im „CD-Diagramm“ liegen alle Proben der frei zugetretenen Gase im Fenster des thermisch generierten Methans. Die Mehrzahl der Gase läßt sich in zwei Gruppen einteilen: Gase mit einem 13C-Wert zwischen ca. -45 ‰ und -40 ‰ sowie einem D-Wert zwischen ca. -200 ‰ und -160 ‰ wurden als Gastyp 1 definiert. Diese Werte charakterisieren das Gas als Methan, wie es typischerweise in Erdölbegleitgasen oder Kondensaten aus marin abgelagerten organischen Substanzen auftritt, siehe FABER (2002). Gase mit einem 13C-Wert um -34 ‰ sowie einem D-Wert zwischen ca. -180 ‰ und -150 ‰ wurden als Gastyp 2 definiert. Dieser Gastyp wurde genetisch nicht eindeutig charakterisiert, allerdings von Faber et al., siehe FABER (1996), als Mischgas aus einem autochthonen Zechsteinprodukt mit geringen Anteilen eines Rotliegendgases gedeutet. Alle Zuflüsse dieses Gastyps wurden stratigraphisch dem Hauptanhydrit (z3HA) als Speichergestein zugeordnet, siehe FABER (2002). Einige wenige Proben sind vermutlich Mischgase aus Gastyp 1 und Gastyp 2, sie stammen aus dem Liniensalz (z3LS) von einer Position, an der der Hauptanydrit ausgequetscht ist. Auch im Bernard-Diagramm, in dem die molekulare Zusammensetzung Methan/(Ethan+Propan) als Funktion des 13C-Wertes von Methan aufgetragen ist, lassen sich Gastyp 1 und Gastyp 2 voneinander differenzieren. Aus der Auftragung wird deutlich, daß der Gastyp 2 methanreicher ist, als Gastyp 1.
Um Typ und Reife der gasgenerierenden Ausgangssubstanz abzuschätzen, verwenden FABER (2002) und Gerling die variablen Methan/Ethan- und Ethan/Propan-Reifelinien nach Berner und Faber, siehe Berner (1996). Die Auftragung des 13C-Wertes von Methan als Funktion des 13C-Wertes von Ethan ermöglicht anhand der Reifelinien eine Abschätzung von Muttergesteinsreifen. Die Proben, die den Gastyp 1 repräsentieren, liegen in dieser Auftragung unterhalb der Reifelinie für sapropelitisches Muttergestein, was auf eine Zumischung von isotopisch leichtem Methan, z.B. bakteriellem oder frühtermischem Methan, zurückgeführt wird. Da das von Faber und Gerling als Muttersubstanz vermutete Staßfurt-Karbonat nach der Ablagerung schnell von impermeablen Evaporiten abgedeckt wurde, interpretieren Faber und Gerling diesen Befund nicht als Zumischung sondern eher als nicht vollzogene Abfuhr der früh gebildeten Komponenten. Unabhängig davon läßt sich aus der Auftragung ableiten, daß die Gase vom Gastyp 1 aus einem marin abgelagerten Muttergestein einer Reife zwischen 0,8 % bis 1,1 % Vitrinitreflexion gebildet wurden, siehe FABER (2002). Die Proben, die den Gastyp 2 repräsentieren, liegen in dieser Auftragung oberhalb der Reifelinie für Gase aus marinem Muttergestein. Daraus schließen Faber und Gerling, daß es sich im Mischgase aus einem marin abgelagertem Muttergestein und einem höherreifen terrestrische Muttergestein handelt. Faber und Gerling nehmen an, daß ca. 40 % bis 45 % des Gastyp 2 aus dem Prä-Zechstein stammen und vermuten als Quelle Rotliegend-Gase, wie sie nordöstlich von Gorleben in Salzwedel-Peckensen vorkommen. In der Auftragung des 13C-Wertes von Propan als Funktion des 13C-Wertes von Ethan liegen alle Proben nahe an der Reifelinie für Gase aus marinen Muttergesteinen und werden dem Gastyp 1 zugeordnet, d.h. die Zumischung von präzechsteinzeitlichem Gas ist nur bei Methan festzustellen. Diese Aussage wird dadurch gestützt, daß das Rotliegend-Gas aus Salzwedel-Peckensen nur aus Methan und Stickstoff besteht.
Salzgebundene Gase
Aufgrund der relativ geringen zur Verfügung stehenden Gasmengen sind zwar für alle Kohlenwasserstoffgase die 13C-Werte von Methan vorhanden, jedoch existieren nur bei ausreichenden Gasmengen auch die D-Werte von Methan und die 13C-Werte von Ethan und Propan, siehe FABER (2002). Im „CD-Diagramm“ der Proben aus den übertätigen Erkundungsbohrungen können wiederum die Gastypen 1 und 2 definiert werden, wie sie bei den Proben aus freien Gaszutritten definiert sind. Jedoch treten daneben auch Proben mit ungewöhnlich positiven Kohlenstoff-Isotopenverhältnissen auf, die als Gastyp 3 definiert wurden. Diese Proben stammen alle aus dem Kaliflöz Staßfurt, siehe GERLING (1988) und GERLING (1991). Eine thermochemische Sulfatreduktion wird von Gerling und Faber aufgrund der moderaten Temperaturen im Salzstock als Ursache ausgeschlossen, zudem wäre diese Erklärung schwer mit der Beobachtung in Einklang zu bringen, daß diese Gase nur im Kaliflöz Staßfurt auftreten. Aus demselben Grund sei auch eine bakterielle Oxidation des Methans unplausibel, unterstützt durch die Beobachtung, daß die Gase aus dem Kaliflöz eher höhere Gasmengen und eine methanreichere Zusammensetzung aufweisen, als die Gase aus den umgebenden Gesteinen, siehe FABER (2002). Diese Beobachtung wird von Faber und Gerling nicht abschließend gedeutet, eine vergleichbare Beobachtung haben SIEMANN (2007) und POTTER et al. (2004) jedoch am Zechstein 2 in Zielitz gemacht. Das 13C/12C-Verhältnis des intrakristallin gebundenen Methans steigt dort von 13C = – 45 ‰ bis – 50 ‰ im basalen Teil des Steinsalzes auf ungewöhnlich 13C-angereicherte Werte von bis zu + 21 ‰ im oberen Bereich des untersuchten Horizonts (Kaliflöz Staßfurt). Ähnlich verlaufen die 13C-Werte für primäre innerkristalline Einschlüsse, während der 13C-Wert für sekundäre, auf Spaltrissen liegende Einschlüsse konstant um – 25 ‰ beträgt. Zur Deutung der ungewöhnlichen 13C-Anreicherung nehmen Siemann und Potter et al. an, daß mit zunehmender Eindunstung leichtes CO2 im Meerwasser abgereichert wurde und das schwerer werdende CO2 von methanogenen Bakterien zu CH4 umgesetzt wurde.
Auch im Bernard-Diagramm, in dem die molekulare Zusammensetzung Methan/(Ethan+Propan) als Funktion des 13C-Wertes von Methan für alle gesteinsgebundenen Gase aus dem Salzstock Gorleben aufgetragen ist, lassen sich Gastyp 1, Gastyp 2 und Gastyp 3 voneinander differenzieren. Die meisten Gasproben liegen dabei im Fenster von Gastyp 1 oder nahe an diesem Fenster. Nur vier Proben befinden sich im Fenster von Gastyp 2. Der Gastyp 3 bildet auch in dieser Darstellung eine klar erkennbare Gruppe, wobei neben Proben aus obertägigen Erkundungsbohrungen auch Proben aus dem Erkundungsbereich 1 unter diesen Gastyp fallen.
Faber und Gerling haben ihre isotopengeochemischen Untersuchungen im Erkundungsbereich 1 weiter differenziert und für den Querschlag 1 Ost, die Nördliche Richtstrecke und den Querschlag 1 West Ergebnisse getrennt angegeben. Im Querschlag 1 Ost enthielten nur wenige Proben ausreichend Methan zur Bestimmung der Wasserstoff-Isotopenverhältnisse. Im „CD-Diagramm“ liegen alle Proben, deren Methangehalt hoch genug war, im Feld für den Gastyp 1 und wurden als autochtone Zeichsteinprodukte identifiziert. Im Bernard-Diagramm liegt die Mehrzahl der Proben im oder nahe am Fenster von Gastyp 1. Für die Gase am Rande des Feldes von Gastyp 1 mit positiveren 13C-Werten bieten Faber und Gerling keine genetische Erklärung an. Einige Proben vom Südende des Querschlags fallen in das Fenster von Gastyp 3. Die Auftragung des 13C-Wertes von Methan als Funktion des 13C-Wertes von Ethan erfolgte nur für wenige Proben, da nur bei wenigen Proben der 13C-Wert von Ethan gemessen wurde. Mit Ausnahme einer Gasprobe liegen alle Gase im Fenster von Gastyp 1 und wurden somit von Faber und Gerling als autochthone Zechsteinprodukte identifiziert. Für die Nördliche Richtstrecke existieren mengenbedingt keine Wasserstoff-Isotopenverhältnisse von Methan und auch keine Kohlenstoff-Isotopverhältnisse von Propan. Im Bernard-Diagramm liegen alle Gase am Rande des Fensters von Gastyp 1. Warum der 13C-Wert von Methan mit ca. – 40 ‰ gegenüber Gastyp 1 zu positiven Werten hin verschoben ist, wird von Faber und Gerling nicht gedeutet. Die Auftragung des 13C-Wertes von Methan als Funktion des 13C-Wertes von Ethan ergibt, daß alle Proben in den Bereich zwischen den drei Fenstern für die Gastypen 1 bis 3 fallen. Die Muttergesteinsreife liegt laut der Reifelinie bei 0,9 % bis 1,1 % Vitrinitreflexion. Für den Querschlag 1 West existieren ebenfalls keine Wasserstoff-Isotopenverhältnisse von Methan und keine Kohlenstoff-Isotopenverhältnisse von Propan. Im Bernard-Diagramm treten vorwiegend zwei Gruppen von Gasen im bzw. nahe am Fenster von Gastyp 1 auf. Neben dem Gastyp 1 treten wiederum Gase mit einem etwas positiveren 13C-Wert von Methan von ca. – 40 ‰ auf, die Proben stammen alle aus dem Streifensalz (z2HS2). Eine Probe fällt in das Fenster von Gastyp 3, sie stammt aus dem Hauptanhydrit (z3HA). Die Auftragung des 13C-Wertes von Methan als Funktion des 13C-Wertes von Ethan ergibt, daß viele Proben in das Fenster von Gastyp 1 fallen. Daneben gibt es eine Gruppe von Gasen mit einem positiveren 13C-Wert von Ethan, was von Faber und Gerling nicht gedeutet wird. Weitere Gasproben plotten in das Feld zwischen den Gastypen 1, 2 und 3, die aus der Reifelinie bestimmte Maturität liegt bei 0,9 % bis 1,1 % Vitrinitreflexion, siehe FABER (2002).
3.2.2.2 Genetische Typisierung flüssiger Kohlenwasserstoffvorkommen im Salzstock Gorleben
Alle in der BGR untersuchten Proben aus der Leine-Folge sind sehr ähnlich. Charakteristisch sind u.a. eine typische Verteilung der n-Alkane mit einem Maximum bei den niedrigsiedenden Komponenten unterhalb n-C10 und Isoheptanwerte zwischen 5 und 6. Der Isoheptanwert ist gemäß Gl. (2) definiert:
n-Heptan*100 / (Cyclohexan + 2-Methylhexan + 1,1-Dimethylcyclopentan +
2,3-Dimethylpentan + 3-Methylhexan + 1,cis-3-Dimethylcyclopentan +
1-trans-3-Dimethylcyclopentan + 1,trans-2-Dimethylcyclopentan + 3-Ethylpentan +
2,2,4-Trimethylpentan + n-Heptan + Methylcyclohexan + 2,2-Dimethylhexan +
1,1,3-Trimethylcyclopentan + 2,2,3,3-Tetramethylbutan) (2)
Die Proben aus dem Knäuelsalz (z2HS1), die in den Querschlägen 1 West und 1 Ost gewonnen wurden, unterscheiden sich hiervon deutlich. Ihr Isoheptanwert liegt zwischen 2 und 3. Weiterhin unterscheidet sich ihre n-Alkanverteilung deutlich von den flüssigen Kohlenwasserstoffen der Leine-Folge, das n-Alkanspektrum reicht bei ihnen deutlich über C30 hinaus. Biomarker fehlen in allen untersuchten Kohlenwasserstoffproben, was auf eine hohe Reife der Fluide schließen läßt. Faber und Gerling schließen daher Reifeunterschiede des generierenden Muttergesteins als Ursache für die unterschiedliche Zusammensetzung mit großer Wahrscheinlichkeit aus, siehe FABER (2002). Das organische Ausgangsmaterial läßt sich nur insoweit eingrenzen, daß Relikte höherer Pflanzen (Pollen, Sporen, Cutine) nicht nachgewiesen wurden. Daher ziehen Faber und Gerling Algen und Mikroben als Quelle in Betracht. Die wegen des hohen Reifegrades nur noch in Ansätzen nachweisbare Bevorzugung der geradzahligen n-Alkane C22, C24 und C26 und ein Pristan/Phytan-Verhältnis < 1 weisen nach diesen Autoren auf ein karbonatisches Muttergestein hin. Diese Parameter sind in vielen Zechstein-Erdölen Nordostdeutschlands in vergleichbarer Weise ausgebildet, wo das Muttergestein Staßfurt-Karbonat (z2SK) gleichzeitig das Speichergestein ist, siehe GERLING (1996). Das 13C/12C-Isotopenverhältnis des Gesamtöls und seiner Fraktionen erreicht einen 13C-Wert von ca. – 27 ‰. Dieser Wert wurde auch in Zechsteinölen Ostdeutschlands gefunden, siehe WEHNER (1997). Faber und Gerling schließen daraus, daß die Genese der flüssigen Kohlenwasserstoffe aus einem zechsteineigenen Muttergestein erfolgte, wobei als Ausgangssubstanz in erster Linie die organische Substanz des Staßfurt-Karbonates (z2SK) in Betracht komme. Die Abweichungen in der Zusammensetzung der Kohlenwasserstoffe aus der Leine-Folge indizieren gemäß Faber und Gerling möglicherweise migrationsbedingte Verluste, sie seien aber nicht derart signifikant, daß auf ein anderes Muttergestein zu schließen sei, siehe FABER (2002). Unter diesen Rahmenbedingungen ziehen Faber und Gerling drei Interpretationen in Betracht:
1. Die Unterschiede in den Kohlenwasserstoffen beruhen auf einer zunehmenden Evaporation und gepulstem Abgang aus der Quelle Staßfurt-Karbonat.
2. Unterschiedliche Migrationsdistanzen der Kohlenwasserstoffe innerhalb des Salzstocks könnten die Ursache sein, wenn man eine frühe Platznahme der Kohlenwasserstoffe vor der Halokinese annimmt. Eine unveränderte Position der Kohlenwasserstoffe seit Beginn der Halokinese ist nach Faber und Gerling jedoch wenig wahrscheinlich.
3. Ein Chromatographie-Effekt infolge der Kohlenwasserstoffbewegung durch den Salzstock erscheint wenig plausibel, da man annehmen kann, daß die Kohlenwasserstoffe i.d.R. über Klüfte migrieren und somit eine Wechselwirkung mit dem umgebenden Medium vernachlässigbar sein sollte.
Obwohl nach Faber und Gerling nur die erste Interpretationsmöglichkeit plausibel scheint, ist es in Anbetracht der limitierten Daten und der Unsicherheit bezüglich des diskreten Abgangs aus der Quelle bislang unmöglich, weitere Schlußfolgerungen zu ziehen.
3.2.2.3 Eindimensionale und dreidimensionale Beckensimulation zur Klärung der Herkunft der Kohlenwasserstoffe im Salzstock Gorleben
SENGLAUB (2001) konnte durch Modellierung der Versenkungsgeschichte der Bohrung Gorleben Z1 in guter Näherung das Erreichen des notwendigen Reifestatiums der organischen Substanz im Staßfurt-Karbonat (z2SK) für die Kohlenwasserstoffgenese bestimmen und somit den frühestmöglichen Zeitpunkt der Migration einengen. Dabei wurden zwei mögliche Sedimentationsszenarien für die Bohrung Gorleben Z 1 beschrieben. Der Unterschied zwischen beiden Szenarien liegt in den abweichenden Vorstellungen über die Hebung der Region Gorleben während der Jungkimmerischen Phase. Im ersten Szenario wird eine Hebung von 700 m simuliert, siehe JARITZ (1969), im zweiten Szenario eine Hebung von 300 m, siehe ZIRNGAST (1991).
SENGLAUB (2001) hat die Temperaturentwicklung des Staßfurtkarbonates während der Absenkung und die Menge an produzierten Kohlenwasserstoffen sowie das Transformationsverhältnis als Funktion der Zeit simuliert. Das Transformationsverhältnis gibt das Verhältnis der gebildeten Kohlenwasserstoffe zur möglichen Gesamtausbeute an.
Mit beginnender Sedimentation des unteren Buntsandsteins erreichte das Staßfurtkarbonat im ersten Szenario eine Temperatur von 60 °C und die Kohlenwasserstoffbildung setzte vor 250 Ma ein. Mit zunehmender Versenkung stiegen die Temperaturen bis zum Ende des Lias auf 120 °C an. In diesen Temperaturbereichen verharrte das Staßfurtkarbonat bis Ende der Unteren Kreide und die Kohlenwasserstoffbildung setzte sich kontinuierlich fort. Mit Übergang des Salzkissens in die Diapirphase und beginnendem Salzabwanderungen aus der Region der Bohrung Gorleben Z1 gelangte das Staßfurtkarbonat in geringer temperierte Teufenbereiche, woraufhin die Bildung der Kohlenwassserstoffe vor 120 Ma aussetzte. Das Staßfurtkarbonat erreichte seitdem nicht mehr Teufen mit Temperaturen über 120 °C, somit konnten auch keine weiteren Kohlenwasserstoffe gebildet werden. In diesem Szenario liegt das Transformationsverhältnis bei 55 % – 58 %, dies entspricht einer Bildung von ca. 0,081 g Kohlenwasserstoffen pro Gramm TOC.
Im zweiten Szenario setzt die Kohlenwasserstoffbildung aus der organischen Substanz des Staßfurtkarbonates ebenfalls mit beginnender Sedimentation des unteren Buntsandsteins vor 250 Ma ein und setzte sich mit zunehmender Versenkung und ansteigenden Temperaturen auf 120 °C bis Ende Dogger kontinuierlich fort. Hebung und Erosion der oberflächennahen Schichten während der Jungkimmerischen Phase im Malm brachten das Staßfurtkarbonat wieder in Teufen niedriger Temperaturen. Dadurch kam es vor 150 Ma zur Stagnation der Kohlenwasserstoffbildung, die bis zum heutigen Zeitpunkt anhält. Das Transformationsverhältnis liegt in diesem Szenario bei 65 % – 70 %, dies entspricht einer Bildung von ca. 0,068 g Kohlenwasserstoffen pro Gramm TOC, siehe SENGLAUB (2001).
Zu ähnlichen Ergebnissen kommt CRAMER (2005) bei einer 3D-Beckensimulation mit der Programmgruppe PetroMod. Nach Cramer begann die Kohlenwasserstoffbildung sowohl im Kupferschiefer, wie auch im Staßfurtkarbonat im Unterjura vor 200 Ma. Bis zur tiefsten Versenkung zur Zeit der maximalen Entwicklung des Salzkissens zum Ende des Jura (145 Ma) war die Kohlenwasserstoffbildung weitgehend abgeschlossen. Bis zu dieser Zeit waren im Kupferschiefer etwa 74 % und im Staßfurtkarbonat etwa 71 % des initialen Bildungspotentials in Kohlenwasserstoffe umgesetzt. Seit dieser Zeit ruhte die Kohlenwasserstoffbildung in beiden Muttergesteinen überwiegend. Erst im späten Tertiär wurden lokal Temperaturen erreicht, die die Kohlenwasserstoffbildung in geringem Umfang reaktivierten. Unterhalb der heutigen Salzstöcke ruht die Kohlenwasserstoffbildung seit dem Beginn des Diapirstadiums. Für heute berechnet das 3D-Modell gemittelt über das Untersuchungsgebiet KW-Bildungsgrade von 76 % für den Kuperschiefer und 73 % für das Staßfurt-Karbonat. Migration von Erdöl und Erdgas entlang von Störungssystemen, die sich zum Beispiel im Zuge des Salzaufstieges öffnen konnten, wurden im 3D-Modell nicht berücksichtigt. Cramer errechnet für das Staßfurtkarbonat einen Kohlenwasserstoffgehalt von 5,5 kg pro m3 Gestein und für den Kupferschiefer 91,5 kg/m3. Daraus leitet Cramer ab, daß eine Migration von Kohlenwasserstoffen aus dem Kupferschiefer im Raum Gorleben viel wahrscheinlicher war, als eine Migration von Kohlenwasserstoffen aus dem Staßfurt-Karbonat. Der überwiegende Anteil der Kohlenwasserstoffe aus dem Kupferschiefer migrierte nach der Simulation abwärts in die Gesteine der Hannover-Formation, dies wird durch geochemische Befunde gestützt, siehe FABER (2002). Dies läßt sich durch die geringer durchlässigen Schichten der Evaporite der Werra Serie am Top des Muttergesteins erklären, die die Strömungsfluß einen größeren Widerstand entgegensetzen, als die klastischen Sedimente der basalen Hannover-Formation. Im Gegensatz zum Kupferschiefer hat das Staßfurt-Karbonat im 3D-Modell bis heute keine Kohlenwasserstoffe an das umgebende Gestein abgegeben. Mit dem Aufstieg des Salzstockes konnten aber Kohlenwasserstoffe aus dem Staßfurt-Karbonat durch die Prozesse der Halokinese in die Gesteine des Salzstockes eingearbeitet werden, siehe CRAMER (2005).
3.2.2.4 Einarbeitung von Kohlenwasserstoffen in den Salzstock Gorleben während der Halokinese
Zur Frage des Migrationsweges der Kohlenwasserstoffe in das Knäuelsalz im Gefolge der Diapirbildung nehmen BORNEMANN et al. (2001) folgendes Denkmodell an:
Während der Deformation zu Beginn der Salzkissenbildung migrieren die Kohlenwasserstoffe aus dem Liegenden in die noch flach gelagerten, als Liniensalz sedimentierten ältesten Schichten des Hauptsalzes. Wegsamkeiten für die Kohlenwasserstoffe werden durch das Zerbrechen der Steinsalzkristallbänke, der feinkristallinen Steinsalzzwischenlagen und der Anhydritlinien geschaffen. Beim Verheilen der Bruchstrukturen erfolgte ein interkristalliner Einbau der Kohlenwasserstoffe in die feinkristalline Steinsalzmatrix und ein intrakristalliner Einbau in die sekundär „verheilten“ Bereiche der Matrix. Die Lösungen zur Bildung der sekundären Halite werden vermutlich beim Zerbrechen aus Fluideinschlüssen der Steinsalzkristalllagen freigesetzt.
Der weitere Salzaufstieg und die Strukturbildung des Diapirs beruhen auf der Dynamik des Hauptsalzes der Staßfurt-Folge, das seinen Weg in die Struktur mit extremer Verfaltung einhergehend, durch weiteres Zerbrechen und Wiederverheilen der Steinsalzschichten zurücklegte. Hierbei kommt es insbesondere im Knäuelsalz zur Homogenisierung der Schichten, die heute keinen sedimentäre Verband mehr erkennen lassen (Brekzie). Die Kohlenwasserstoffe wurden während dieses Prozesses immer wieder mobilisiert und durch das Wiederverheilen erneut in das umgebende Steinsalz eingebunden. Die Verteilung der Vorkommen ist infolge der Homogenisierung der Schichten rein zufällig.
Das nahezu ausschließliche Vorkommen der Kohlenwasserstoffe im Knäuelsalz läßt sich vermutlich dadurch begründen, daß das hangende Streifen- und Kristallbrockensalz zwar ebenfalls brekziert, jedoch oftmals der sedimentäre Verband noch rudimentär erkennbar ist, wodurch die Migration der Kohlenwasserstoffe in diese Schichten wegen der geringeren Deformation nicht möglich war.
3.2.3 Gehalte an Kohlenwasserstoffen im Salzstock Gorleben
Bei den Erkundungsarbeiten am Salzstock Gorleben wurden zunächst Evaporite aus einigen Bohrungen der übertägigen Erkundung vereinzelt auf Gasgehalte hin untersucht. Auch beim Abteufen der Schächte sowie bei der untertägigen Erkundung wurden die abgebauten Salze auf das Vorkommen von gesteinsgebundenen Kohlenwasserstoffen hin untersucht, siehe FABER (2001), GERLING (1988) und GERLING (1991):
Aus einigen obertägigen Erkundungs-, Salzspiegel-, und Schachtvorbohrungen wurde jeweils eine bis mehrere Einzelproben genommen. Aus den Bohrungen Go 1002 und Go 1005 wurden Proben im Rahmen eines umfangreicheren Teufenprofils genommen. Aus den Schächten 1 und 2 wurden im Abstand von je 10 m Proben genommen.
Im Querschlag 1 Ost wurden ab dem Bohrort 3 bis zum Ende der Strecke ca. alle 5 m eine Salzprobe genommen. Weiterhin wurden einige Proben vom Bohrort 3.1 und eine Probe aus der Nische 302 genommen. Aus der Nördlichen Richtstrecke wurden durchgängig alle fünf Meter Proben genommen. Im Querschlag 1 West erfolgte die Beprobung nicht durchgängig. Engständige Proben wurden im nördlichen und südlichen Drittel der Strecken genommen, dazu einige Proben aus dem Sattelkern. Einige wenige Proben stammen vom Wetterberg zur 2. Sohle sowie aus Bohrungen vom Füllort Schacht 2, siehe FABER (2002).
Insgesamt wurden 524 Proben genommen, davon 185 Bohrkernproben, die restlichen Proben sind als „Salz“ bezeichnet. Die Analyse des Kohlenwasserstoffgehalts erfolgte immer in einem so genannten Salzblender. Dabei werden etwa 200 g bis 400 g Gestein in vorher entgastem Wasser aufgelöst und das sich dabei freisetzende Gas im prä-evakuierten Kopfraum (Headspace) des Reaktionsgefäßes aufgefangen. Durch Zufuhr von Flüssigkeit wurde anschließend der Kopfraum komprimiert und das Gas in ein gläsernes Gefäß zur weiteren Probenbearbeitung überführt. Das Verhältnis von Wasser und Salzgestein wurde so gewählt, daß nach dem Auflösen eine nahezu gesättigte Lösung vorlag, um eine Rücklösung der Gase in die Salzlösung zu vermindern, siehe FABER (2001). Von den Proben wurden 89 bei der Firma GCA Schmitt (Lehrte) analysiert, dabei handelt es sich ausschließlich um Bohrkernproben. Die restlichen Proben wurden im Labor der BGR analysiert. Bei GCA Schmitt wurden die Salzproben vor dem Auflösen zerkleinert, im Labor der BGR wurden die Proben unzerkleinert aufgelöst.
Nach ersten Interpretationen der salzgebundenen Gase wurde vermutet, daß sich ein Teil der im Gestein befindlichen Gase dieses bereits nach Veränderung der untertägigen in-situ-Bedingungen verläßt. Diese Vermutung wird durch neuere Literatur bestätigt, wonach sich Gase, die an den Korngrenzen gespeichert sind, durch Zerkleinern der Salzprobe freisetzen lassen, siehe SIEMANN (2007). Die Zerkleinerung der Salzproben bei der Firma GCA Schmitt (Lehrte) vor dem Auflösen ist in Anbetracht dieser Erkenntnis als Schwachstelle anzusehen. Die Zeit zwischen der Probennahme und der Analyse beträgt bei Faber und Gerling zudem einige Wochen bis Jahre, siehe GERLING (1991), es kann also eine Entgasung stattgefunden haben.
Ab Beginn des Schacht-Abteufens wurden alle Gesteinsproben bei der Probennahme in Acrylbehältern verschlossen und das sich im Headspaceraum ansammelnde Gas vor der Probenbearbeitung im Salzblender vermessen. Die Untersuchung der Probenbehälter ergab jedoch, daß diese nicht gasdicht verschlossen waren. Ursache hierfür waren i.d.R. feinkörnige Salzpartikel im Behälterverschluß. Durch geänderte Behälterverschlüsse und Hinweise an die Probennehmer wurde dieses Problem 1998 behoben, siehe FABER (2001). Auf diese sog. Headspace-Gase wird aufgrund der geschilderten Probleme in diesem Bericht nicht eingegangen.
Die mit dem Salzblender ermittelten Gasmengen wurden von Faber und Gerling in ppb [gGas/gGestein*109] angegeben. Analysiert wurden dabei die Gase C1 (Methan) bis C5 (Pentan). Nach den Untersuchungen von Faber und Gerling, siehe GERLING (1991) und FABER (2001), ist dabei Methan der dominierende Kohlenwasserstoff. Der Methangehalt in den Salzproben beträgt zwischen 1 ppb und 19892 ppb, im Mittel sind es 254 ppb. Der Gehalt an der Summe der Kohlenwasserstoffe C1 bis C5 beträgt im Mittel 452 ppb. Verglichen mit Gasgehalten in anderen Salzstöcken sind die Kohlenwasserstoffgehalte in Gorleben gleich hoch oder geringer, vergleiche hierzu HEMPEL (1974), MÜLLER (1956) und JOCKWER (1997), siehe auch Tab. 1.
Aus der engständigen Beprobung der Bohrungen Go 1002 und Go 1004 haben Gerling et al. den Kohlenwasserstoffgehalt als Funktion der Teufe ermittelt. Dabei hat sich herausgestellt, daß methanreichere Abschnitte v.a. in carnallitischen Lagen und im Kaliflöz Staßfurt auftreten, sowie im Liniensalz (z3LS) und im Bänderanyhdrid (z3HA11), siehe GERLING (1991) und FABER (2002).
Im Schacht 1 wurde etwa alle 10 m eine Probe genommen. Die Methangehalte der salzgebundenen Gase liegen i.d.R. unter 20 ppb, im z3LS und im z3OS wurden vereinzelt höhere Werte, jedoch unter 100 ppb gefunden. Auch im Schacht 2 wurden etwa alle 10 m Proben gewonnen. Hier variierte der Methangehalt jedoch zwischen < 10 ppb bis hin zu über 1000 ppb. Besonders hohe Methangehalte traten in der Gorleben-Bank und im z3BK/BD in 826 m Teufe auf.
Im Erkundungsbereich 1 wurde der Querschlag 1 Ost, der Querschlag 1 West und die Nördliche Richtstrecke beprobt. Im Querschlag 1 Ost schwankt der Methangehalt wiederkehrend zwischen höheren und geringen Werten. Der Methangehalt in der Nördlichen Richtstrecke liegt hingegen relativ gleichmäßig zwischen etwa 20 ppb und 40 ppb. Nur wenige Werte liegen darüber, bleiben jedoch unter 80 ppb. Der Querschlag 1 West wurde nicht durchgängig beprobt. Der Methangehalt ist im Knäuelsalz am höchsten und erreicht dort Werte über 50 ppb.
Zusammenfassend ist die Verteilung der Kohlenwasserstoffe im Salzstock variabel. Für die salzgebundenen Gase gilt, daß untertage die größten Mengen im Knäuelsalz (z2HS1) nachgewiesen wurden. Diese Gase sind i.d.R. auch angereichert mit höheren Homologen. Aus den übertätigen Erkundungsbohrungen wurden die höchsten Gasgehalte in den Knistercarnalliten, sowie gelegentlich im Orangesalz und insbesondere in der Gorleben-Bank gefunden, siehe FABER (2002).
Literaturverzeichnis
BERNARD, B. B., BROOKS, J. M. & SACKETT, W. M. (1976): Natural gas seepage in the Gulf of Mexico. – Earth and Planet. Sci. Lett. 31: 45-54
BERNER, U. & FABER, E. (1996): Empirical carbon isotope/maturity relationships for gases from algal kerogens and terrigeneous organic matter, based on dry, open-system pyrolysis. – Org. Cheochem. 10/11: 947-955
BORNEMANN, O., BÄUERLE, G., BEHLAU, J., MINGERZAHN, G. (2001): Geologische Bearbeitung der Erkundungssohle (Geologie, Mineralogie, Geochemie). 1. Geologischer Ergebnisbericht EB1. – BGR-Bericht, Tagebuch-Nr. 10214/01, 111 S.
CRAMER, B. (2005): Erdölgeologische 3D-Modellierung des Salzstockes Gorleben. – BGR-Bericht, Tagebuch-Nr. 11835/04
GERLING, P., FABER, E. (2001): Dokumentation der chemischen Analysen von gasförmigen und flüssigen Kohlenwasserstoffen. – BGR-Bericht , Tagebuch-Nr. 10717/01, 20 S.
GERLING, P., FABER, E. & WEHNER, H. (2002): Interpretation der chemischen Analysen von gasförmigen und flüssigen Kohlenwasserstoffen. – BGR-Bericht, Tagebuch-Nr. 12243/02, 82 S.
FREYER, H. D. (1978): Degradation Products of Organic Matter in Evaporites containing trapped Atmospheric Gases, Chemical Geology 23, 293 – 307
GERLING, P.,WHITICAR, M. J. & FABER E. (1988): Extreme Isotope Fractionation of Hydrocarbon Gases in Permian Salt, Organic Geochemistry 13, 335 – 341
GERLING, P., BEER, W., BORNEMANN, O. (1991): Gasförmige Kohlenwasserstoffe in Evaporiten des deutschen Zechsteins, Kali und Steinsalz 10, 376-383
GERLING, P., PISKE, J., RASCH, H.-J. & WEHNER, H. (1996): Paläogeographie, Organofazies und Genese von Kohlenwasserstoffen im Staßfurt-Karbonat Ostdeutschlands – (2) Genese von Erdölen und Erdölbegleitgasen. – Erdöl Erdgas Kohle 112 (4), 152 – 156
GRISHINA, S., PIRONON, J., MAZUROV, M., GORYAINOV, S., PUSTILIKOV, A., FON-DER-FLAAS, G. & GUERCI, A. (1998): Organic inclusions in salt. Part 3. Oil and gas inclusions in Cambrian
evaporite deposit from East Siberia. A contribution to the understanding of nitrogen generation in evaporates, Organic Geochemistry 28, 297-310
GROPP (1919): Gasvorkommen in den Kalibergwerken in den Jahren 1907 bis 1917, Kali 13 (1919), 33-42
GRÜBLER, G. (1984): Gasvorkommen in den Schachtvorbohrungen Go 5001 und Go 5002. – BMFT-Publikation Entsorgung 3: Bericht von einer Informationsveranstaltung des Bundes vor dem Schachtabteufen, Salzstock Gorleben: 165-181, 6 Abb.; Bonn.
HEMPEL, D (1974): Neuere Erkenntnisse über das Auftreten natürlicher brennbarer Gase in Kaligruben der DDR, Neue Bergbautechnik 4, 592 – 596
JARITZ, W. (1969): Epirogenese in NW-Deutschland im höheren Jura und in der Unterkreide. – Geol. Jb. A10: 1 – 77, 3 Abb., 1 Tab., 2 Taf.; Hannover.
JOCKWER, N. (1997): Natürliche Gase im Salzgestein Freisetzung und Verbleib in: Erzeugung und Verbleib von Gasen in einem Endlager für radioaktive Abfälle. Gesellschaft für Anlagen- und Reaktorsicherheit (GRS) mbH
KNABE, H.-J. (1989): Zur analytischen Bestimmung und geochemischen Verteilung der gesteinsgebundenen Gase im Salinar, Zeitschrift geologische Wissenschaften 17, 353 – 368
KOVALEVICH, V. M., PERYT, T. M., SHANINA S. N. & WIECLAW D. (2008): Geochemical Aureoles around Oil and Gas Accumulations in the Zechstein (Upper Permian) of Poland: Analysis of Fluid Inclusions in Halite and Bitumens in Rock Salt, Journal of Petroleum Geology 31, 245-262
MÜLLER, P. UND HEYMEL, W. (1956): Verfahren zur Bestimmung der Gaskonzentration der Gassalze des Südharz- und des Werrakalibergbaues, Bergbautechnik 6, 313 – 319
PIRONON, J., PAGEL, M., LÉVÊQUE, M.-H. & MOGÉ, M. (1995A): Organic Inclusions in Salt. Part 1: Solid and Liquid Organic Matter, Carbon Dioxide and Nitrogen Species in Fluid Inclusions from the Bresse Basin (France), Organic Geochemistry 23, 391-402
PIRONON, J., PAGEL, M., WALGENWITZ F. & BARRÈS O. (1995B): Organic Inclusions in Salt. Part 2: Oil, Gas and Ammonium in Inclusions from the Garbon Margin, Organic Geochemistry 23, 739-750
POTTER, J., SIEMANN, M. G. & TSYPUKOV, M. (2004): Large-scale Isotope Fractionation in Evaporites and the Generation of extremely 13C-enriched Methane, Geology 32, 533-536
PROHL, H. (1998): Raman-spektroskopische Untersuchungen zur Zusammensetzung gasförmiger Einschlüsse in Gesteinen des Salzstocks Gorleben, Dissertation, Technische Universität Clausthal
SCHOELL, M. (1980): The hydrogen and carbon isotopic composition of methane from natural gases of various origins. – Geochim. Cosmochim. Acta, 44: 649-661
SCHOELL, M. (1984): Wasserstoff- und Kohlenstoffisotope in organischen Substanzen, Erdölen und Erdgasen. – Geol. Jb., D67: 3-161
SCHOENHERR, J., URAI, J. L., KUKLA, P. A., LITTKE, R., SCHLÉDER, Z., LARROQUE J.-M., NEWALL, M. J., AL-ABRY, N., AL-SIYABI, H. A. & Z. RAWAHI (2007): Limits of the Sealing Capacity of Rock Salt: A Case Study of the Infra Cambrian Ara Salt from the South Oman Salt Basin, AAPG Bulletin 91, 1541-1557
SCHRADER, R., ACKERMANN, G. & GRUND, H. (1960): Entwicklung von Methoden zur Bestimmung des Gasgehalts in Salzen, Bergakademie 12, 543 – 551
SENGLAUB, Y. (2001): Einfluß der Salzdynamik auf die Kohlenwasserstoffbildung im Staßfurt-Karbonat in der Bohrung Gorleben Z1. – Diplomarbeit Universität Hannover, 58 + 29 S.
SHANINA, S. N., BUSHNEV, D. A. & YUSHKIN, N. P. (2000): Composition and Genesis of Hydrocarbon Inclusions in Salt Minerals from the Verkhnyaya Kama Deposit, Doklady Earth Sciences 373, 871-873
SIEMANN, M. G. (2007): Herkunft und Migration Mineralgebundener Gase der Zechstein 2 Schichten in Zielitz, Kali und Steinsalz 3/2007, 26-41
SONNENFELD P. (1985): Evaporites as Oil and Gas Source Rocks, Journal of Petroleum Geology 8, 253-271
WEHNER, H. (1997): Source and Maturation of Crude Oils in northern and eastern Germany – an Organic Geochemical Approach. – Geol. Jb. D103, 85-102
ZIRNGAST, M. (1991): Die Entwicklungsgeschichte des Salzstocks Gorleben. – Ergebnis einer strukturgeologischen Bearbeitung. – Geol. Jb., A132: 3-31; Hannover.
Hallo,
ich habe noch einen Theorie-Teil und einen experimentellen Teil, den ich hier nur rudimentär darstellen kann, da die Graphiken nicht gezeigt werden. Vielleicht ist er dennoch aufschlußreich:
Chemische Reaktionen bei Aufheizexperimenten
an Kohlenwasserstoffen
in Anwesenheit von Salzen
Inhaltsverzeichnis
1 Einleitung 3
1.1 Motivation 3
1.2 Inventar chemischer Verbindungen im Salzstock Gorleben 4
2 Chemische Reaktionen, die unter den vorliegenden Bedingungen ablaufen können 5
2.1 Cracking von Kohlenwasserstoffen 5
2.2 Thermochemische Sulfatreduktion 14
2.3 Partialoxidation von Kohlenwasserstoffen 16
2.4 Totaloxidation von Kohlenwasserstoffen 20
2.5 Folgereaktionen der Partialoxidation und der Totaloxidation von
Kohlenwasserstoffen 21
2.6 Folgereaktionen des Crackings und der Partialoxidation und Totaloxidation
von Kohlenwasserstoffen: Halogenierung, Sulfonierung und Sulfatierung von
Kohlenwasserstoffen 22
3 Experimentelles Vorgehen 23
3.1 Einleitung 23
3.2 Experimentelle Methodik 24
3.3 Wahl der Reaktionsbedingungen 25
4 Versuchsergebnisse 27
4.1 Totaloxidation von Kohlenwasserstoffen 27
4.2 Partialoxidation von Kohlenwasserstoffen 30
4.3 Cracken von Kohlenwasserstoffen 34
4.4 Einfluss der Salzmenge auf das Cracken von Kohlenwasserstoffen 38
4.5 Einfluss von Kugelmahlen auf das Cracken und weitere chemische Reaktionen
von Kohlenwasserstoffen 42
4.6 Halogenierung von Kohlenwasserstoffen 50
5 Zusammenfassung 52
6 Literaturverzeichnis 53
1 Einleitung
1. 1 Motivation
Wird hoch radioaktiver, wärmeentwickelnder Abfall in ein Bergwerk eingebracht, so kommt es zu einer Erhöhung der Temperatur. Die Auslegungstemperatur beträgt dabei 200 °C, siehe ENGELMANN (1993). Die Temperatur als Funktion der Zeit in verschiedenen Abständen vom Behälter ist für zwei verschiedene Berechnungen in den Abb. 1 und 2 dargestellt.
Abb. 1: Temperatur des Salzes als Funktion der Zeit in der Nähe eines Atommüll-Behälters. Berechnung nach ENGELMANN (1993).
Abb. 2: Temperatur des Salzes als Funktion der Zeit in der Nähe eines Atommüll-Behälters. Berechnung nach BALTES (1986).
Durch die erhöhten Temperaturen können chemische Reaktionen initialisiert oder beschleunigt werden. Zunächst ist daher zu prüfen, welche chemischen Reaktionen möglicherweise ablaufen können. Hierfür muss bekannt sein, wie das Inventar chemischer Verbindungen im Salzstock Gorleben zusammengesetzt ist.
1. 2 Inventar chemischer Verbindungen im Salzstock Gorleben
Hauptsächlich besteht das Salz des Salzstockes Gorleben aus NaCl. Das Knäuelsalz (z2HS1) enthält im Mittel ca. 5 % Anhydrit (Literatur!) und kann in Teilbereichen anhydritische Einschaltungen zwischen 10 % bis 20 % enthalten, siehe KELLER (2007). Bei Anhydrit handelt es sich um CaSO4. Daneben findet man in Spuren K+, Mg2+, Sr2+, Rb+ und Br-.
Mittels Laser-Raman-Spektroskopie hat PROHL (1998) gasführende Einschlüsse des Salzstocks Gorleben untersucht. Prohl fand in den Einschlüssen die Gase N2, O2, Methan, Ethan, H2 und H2S.
Durch die Bewetterung ist nach der Einlagerung mit Grubenluft im Einlagerungsbereich zu rechnen, denn auch bei Verfüllung der Schächte bleibt Luft im Grubengebäude, da die Porosität einer kompaktierten Schüttung ca. 34 % beträgt, siehe WEBER (2011). An Salzproben aus dem Erkundungsbereich 1 im Salzstock Gorleben wurden durchschnittlich 0,0164 Gew.-% H2O im Hauptsalz bestimmt. Die Wassergehaltsbestimmungen im Knäuelsalz, Streifensalz und Kristallbrockensalz ergaben Gehalte von 0,014 Gew.-%, 0,017 Gew.-% bzw. 0,012 Gew.-%. Wenn unterstellt wird, dass ein durchschnittlicher Lösungsgehalt (H2O) von < 0,02 Gew.-% in Form von intra- und interkristallinen Flüssigkeitseinschlüssen vorliegen, dann würden daraus pro m3 Salzgestein etwa < 0,43 Liter Wasser zur Verfügung stehen (KELLER 2007).
2 Chemische Reaktionen, die unter den vorliegenden Bedingungen ablaufen können
2.1 Cracking von Kohlenwasserstoffen
Beim thermischen Cracken geraten die langen Kohlenwasserstoffmoleküle in so starke Schwingungen, dass die Kohlenwasserstoffketten brechen. Es entstehen kurzkettige gesättigte und ungesättigte Kohlenwasserstoffmoleküle, aber auch durch Rekombination langkettige Kohlenwasserstoffmoleküle, sowie aromatische Kohlenwasserstoffmoleküle und Kohlenstoff. In Gleichung (1) ist das Cracken von n-Octan zu Butan und Buten beispielhaft dargestellt:
+ (1)
n-Octan n-Butan 1-Buten
Die Auswirkungen sind in diesem Beispiel eine Zunahme der Molzahl um den Faktor 2 und somit eine Vergrößerung des Volumens um den Faktor 2 bzw. eine Erhöhung des Drucks um den Faktor 2, wenn das Volumen als konstant angenommen werden kann. Natürlich können auch Butan und Buten weiter cracken, wobei kurzkettigere Moleküle entstehen, was zu einer noch größeren Zunahme der Molzahl führt. Aus stöchiometrischen Gründen kann Methan (CH4) aber nicht das alleinige Endprodukt des Crackens sein, es entstehen dann zusätzlich an Kohlenstoff reichere Moleküle mit Doppelbindungen, Aromaten oder Kohlenstoff, es sei denn, der Reaktionsmischung wird Wasserstoff zum Ausgleich der Stöchiometrie zugesetzt („Hydrocracken“). Auch Erdgas mit seinem Hauptbestandteil Methan (CH4) entsteht durch das Cracken von Erdöl, welches ein Gemisch aus Kohlenwasserstoffen mit größerer Kettenlänge ist. Der Aufbau von Molekülen mit größerer Kettenlänge durch Rekombination von Radikalen (siehe Gl. (39)) wird zwar auch beobachtet, jedoch entstehen beim Cracking überwiegend kurzkettigere Verbindungen, wie man anhand von Erdgaslagerstätten weiß.
Der Reaktionsmechanismus des thermischen Crackens erfolgt über Radikal-Kettenreaktionen. Die früheste gefundene Untersuchung zum radikalischen Zerfall gesättigter Kohlenwasserstoffe stammt von F. O. RICE (1931). Rice nimmt an, dass ein organisches Molekül, das zerfällt, in zwei oder mehrere Radikale zerfällt. Aus der Bindungsstärke der C-C-Bindung (ca. 297 kJ/mol) und der C-H-Bindung (ca. 389 kJ/mol) schließt dieser Autor, dass der C-H-Bindungsbruch gegenüber dem C-C-Bindungsbruch als Initialisierungsreaktion vernachlässigbar ist. Rice stellt Reaktionsmechanismen für den Zerfall von Ethan, Propan, n-Butan, iso-Butan, n-Pentan, iso-Pentan und neo-Pentan auf. Für den Zerfall von Ethan postuliert Rice beispielsweise folgenden Reaktionsmechanismus:
(2)
(3)
(4)
(5)
Auch neuere Autoren nehmen einen solchen Reaktionsmechanismus an. Bei längerkettigen Kohlenwasserstoffen ergeben sich allerdings eine Vielzahl an Reaktionsschritten, die nachfolgend am Beispiel des Crackings von n-Hexan dargestellt sind, siehe Dominé (1988). Man kann dabei zwischen Initialisierung (homolytischer Bindungsbruch), Wasserstofftransfer, Zerfall, Isomerisierung, Addition und Rekombination differenzieren.
Initialisierung:
(6)
(7)
(8)
Wasserstoff-Transfer:
(9)
(10)
(11)
(12)
(13)
(14)
(15)
(16)
(17)
(18)
Zerfall:
(19)
(20)
(21)
(22)
(23)
(24)
(25)
(26)
(27)
(28)
(29)
(30)
Isomerisierung:
(31)
Addition:
(32)
(33)
(34)
(35)
(36)
(37)
(38)
Rekombination:
(39)
Natürlich sind u.a. noch mehr Rekombinationsreaktionen denkbar, als im Reaktionsschema von Dominé angegeben. Ein unvollständiges Reaktionsschema des Crackings eines relativ kleinen Moleküls wie n-Hexan beinhaltet bereits 34 Einzelreaktionen. Für eine Computersimulation des Crackings von Hexan stellt BOUNACEUR (2002) einen Reaktionsmechanismus mit 218 Einzelreaktionen auf. Mit zunehmender Kettenlänge des crackenden Moleküls nimmt die Zahl der möglichen Einzelreaktionen zu. Für das Cracking von Tetradecan werden in einem Modell von BOUNACEUR (2002) bereits 1700 Einzelreaktionen berücksichtigt. Berücksichtigt man, dass natürliches Erdöl ein Gemisch aus vielen Kohlenwasserstoffen unterschiedlicher Kettenlänge ist, ergibt sich eine nahezu unüberschaubare Anzahl von Einzelreaktionen. Für ein Modellgemisch aus 52 Komponenten, welches Leichtöl darstellen soll, stellt DOMINÉ (2002) einen Reaktionsmechanismus mit 5200 Radikalreaktionen auf. Für ein Modellgemisch aus 78 Komponenten (C1-C32) werden in einem Modell von BURKLÉ-VITZTHUM (2011) bereits 13206 Einzelreaktionen berücksichtigt.
Das Cracking von Kohlenwasserstoffen ist thermisch aktiviert. Zunächst ist daher zu klären, welches der geschwindigkeitsbestimmende Schritt ist. Thermodynamische Daten für die Einzelreaktionen des Cracking von Hexan findet man bei DOMINÉ (1998).
Initialisierung
82,5
Wasserstoff-Transfer
28,1
29,1
28,8
28,5
Zerfall
28,8
29,1
28,8
28,5
28,5
Addition
7
7,5
7
7,5
7
7,5
Rekombination
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
Für eine thermisch aktivierte Reaktion gilt der empirisch gefundene Arrhenius-Ansatz:
(40)
In Tabelle 1 sind die errechneten Geschwindigkeitskonstanten für je eine Initialisierungsreaktion, einen Wasserstoff-Transfer, eine Zerfallsreaktion eine Additionsreaktion und eine Rekombinationsreaktion dargestellt. Da die thermodynamischen Daten für die jeweiligen Teilreaktionen in derselben Größenordnung liegen, kann man die Ergebnisse als charakteristisch für die Teilreaktionen annehmen.
Tabelle 1: Reaktionsgeschwindigkeitskonstanten k für Teilreaktionen des Crackings von Hexan für 200°C und für 300 °C, errechnet nach den Daten von DOMINÉ (1998)
Nach den Daten von DOMINÉ (1998) ist die Initialisierung der geschwindigkeitsbestimmende Schritt beim Cracking von Hexan. Die Reaktionsgeschwindigkeitskonstante liegt viele Zehnerpotenzen unter den Geschwindigkeitskonstanten der anderen Teilreaktionen. Die Reaktionsgeschwindigkeitskonstanten steigen in der Reihenfolge Initialisierung < Wasserstoff-Transfer < Zerfall < Addition < Rekombination.
Geht man davon aus, dass die Initialisierung der geschwindigkeitsbestimmende Schritt ist, erhält man für ein komplexes Kohlenwasserstoffgemisch wie natürlichem Erdöl eine nahezu unüberschaubare Anzahl von Geschwindigkeitskonstanten.
Eine Sammlung thermodynamischer Daten für das Cracking von Kohlenwasserstoffen findet man bei ALLARA (1980). Für das Cracking von Ethan findet man bei ALLARA (1980) fünf Quellenangaben, deren Werte sich voneinander unterscheiden. Aus diesen Angaben von Allara wurden die Geschwindigkeitskonstanten für zwei verschiedene Temperaturen (315°C und 200°C) errechnet, siehe Tabelle 2:
Tabelle 2: Reaktionsgeschwindigkeitskonstanten k der Initialisierungsreaktion für das Cracking von Ethan für 200°C und für 315 °C, errechnet nach den Daten von Allara.
Es wird deutlich, dass sich die errechneten Geschwindigkeitskonstanten um einen Faktor von bis zu 4,91 unterscheiden. Dies macht schon die Modellierung einer einfachen Reaktion, wie das Cracking von Ethan schwierig, da keine eindeutigen und zuverlässigen thermodynamischen Daten vorliegen.
Beim Cracking eines Kohlenwasserstoffs handelt es sich um eine Reaktion 1. Ordnung. Nur ein Molekül ist am geschwindigkeitsbestimmenden Schritt beteiligt. Die Reaktionsgeschwindigkeit einer Reaktion 1. Ordnung berechnet sich nach Gl. (41):
(41)
Die Konzentration der Eduktspezies i als Funktion der Zeit bei einer Reaktion 1. Ordnung berechnet sich nach Gl. (42):
(42)
Daraus kann mit Gl. (42) der Umsatz Ui der Komponente i berechnet werden:
(43)
Das Cracking von Ethan ist eine vergleichsweise langsame Reaktion. Auf Basis der Reaktionsgeschwindigkeitskonstanten aus Tabelle 2 wurde mit den Gleichungen (41) und (42) die Zeit berechnet, die zu einem signifikanten Umsatz in der Größenordnung von ca. 10 % bis 50 % führt. Bei T = 200 °C sind dies ca. Jahre und bei T = 315 °C werden ähnliche Umsätze schon nach Jahren erreicht.
Tabelle 3: Umsatz des Cracking von Ethan bei T = 200 °C nach einer Reaktionsdauer von Jahren.
Tabelle 4: Umsatz des Cracking von Ethan bei T = 315 °C nach einer Reaktionsdauer von Jahren.
Bei 315 °C würde ein signifikanter Umsatz demnach nach ca. 32 Millionen Jahren erreicht. Bei 200 °C würde sich dieser Umsatz erst nach Jahren einstellen.
Diese kinetischen Daten gelten jedoch für chemisch reines Ethan und sind nicht auf Systeme übertragbar, wo Kohlenwasserstoffe im Kontakt mit Mineraloberflächen stehen. Mineraloberflächen können chemische Reaktionen katalysieren, so dass die Reaktionsgeschwindigkeit um viele Größenordnungen erhöht wird. In der Industrie werden Zeolithe, dabei handelt es sich um Alumosilikate, für das sogenannte Fluid Catalytic Cracking (FCC) eingesetzt. Solche Katalysatoren senken die Aktivierungsenergie einer chemischen Reaktion und somit erhöht sich nach Gl. (40) die Reaktionsgeschwindigkeitskonstante und damit die Reaktionsgeschwindigkeit gemäß Gl. (41). Katalysatoren verfügen über sogenannte “aktive Zentren”. Dabei kann es sich beispielsweise um Fehlstellen (Gitterdefekte) oder um saure Zentren handeln. Beim Mars-van-Krevelen-Mechanismus wird der Katalysator selbst reduziert und wieder oxidiert. Allen Katalysatoren ist gemein, dass sie unverändert aus der Reaktion hervorgehen. Die Zeolithe, die für das Fluid Catalytic Cracking eingesetzt werden, verfügen über saure Zentren. Es handelt sich dabei sowohl um Lewis-Säuren, wie auch um Brönstedt-Säuren. Die katalytische Aktivität läßt sich durch Zugabe von Alkali- und Erdalkali-Ionen, Übergangsmetall-Ionen, seltenen Erden oder Phosphor modifizieren. Einen Überblick über das Fluid Catalytic Cracking erhält man bei RAHIMI (2011). Die kinetischen Daten z.B. von Dominé oder Allara sind daher weder auf Lagerstättenbedingungen übertragbar, noch auf Kohlenwasserstoffvorkommen im Steinsalz. Es ist nicht bekannt, wie sich die Mineralmatrix in solchen natürlichen Systemen auf die Reaktionsgeschwindigkeit des Crackings von Kohlenwasserstoffen auswirkt.
2.2 Thermochemische Sulfatreduktion
Die thermochemische Sulfatreduktion (TSR) ist ein gut bekannter Prozess, der zu „sauren“, d.h. H2S-reichen Gasvorkommen führt. Es handelt sich um eine Redox-Reaktion, bei der Sulfat ( ) als Oxidationsmittel für Kohlenwasserstoffe dient. Die Kohlenwasserstoffe werden dabei partiell (z. B. zu Alkoholen, Ethern, Aldehyden, Ketonen, Estern, Karbonsäuren oder anderen sauerstoffhaltigen organischen Produkten) oder total (zu Kohlenstoffdioxid, also ) oxidiert und das Sulfat wird reduziert. Da Schwefel viele verschiedene Oxidationsstufen kennt, kann bei dieser Reduktion ein komplexes Produktgemisch an Schwefelverbindungen entstehen. Denkbare Produkte sind hierbei Sulfit ( , , elementarer Schwefel ( ) oder auch Schwefelwasserstoff. Daneben können auch Organoschwefelverbindungen (Oxidationsstufen in Klammern) wie Thiole (-2), Thiophenole (-2), Sulfide (Thioeter) (-2), Disulfide (-1), Sulfinsäuren (+2), Sulfonsäuren (+4), Sulfonsäurederivate (+4), Sulfoxide (0), Sulfone (+2), Sulfensäuren (0), Alkylsulfate (+4), Dialkylsulfate (+4) oder in Gegenwart stickstoffhaltiger Verbindungen Thioharnstoffe entstehen. Bruttogleichungen für die thermochemische Sulfatreduktion mit verschiedenen Kohlenwasserstoffen findet man u.a. bei WORDEN (1996):
(44)
(45)
(46)
Die Reaktionsgleichung (43) wird auch von BILDSTEIN (2001) und CROSS (2004) als Bruttogleichung für die thermochemische Sulfatreduktion angegeben.
Eine vereinfachte Bruttogleichung ist auch bei GOLDSTEIN (1994) angegeben:
(47)
Reaktionsgleichungen, die zu partiell oxidierten Kohlenwasserstoffen als Produkt führen, findet man bei MACHEL (2001):
(48)
(49)
(50)
Der elementare Schwefel wird nach MACHEL (2001) auf verschiedenen Wegen aus Schwefelwasserstoff gebildet, einerseits durch Oxidation mit Sauerstoff, andererseits durch eine Synproportionierung mit Sulfat ( in einem sauren Medium (mit Schwefelsäure):
(51)
(52)
(53)
Elementarer Schwefel wird nach MACHEL (2001) seinerseits mit Kohlenwasserstoffen zu Schwefelwasserstoff reduziert, siehe Gl. (53). Handstücke aus Erdöl-Lagerstätten zeigen jedoch, dass elementarer Schwefel auch ein Endprodukt der thermochemischen Sulfatreduktion sein kann.
(54)
Nach MACHEL (2001) bilden sich unter natürlichen Bedingungen mit Rohöl und/oder Erdgas als Kohlenstoffquelle als weitere Produkte Naphtensäuren, ein Gemisch aus alkylierten Cyclopentan- und Cyclohexansäuren, aromatische Verbindungen, festes Bitumen und zahlreiche anorganische und organische Schwefelverbindungen wie Polysulfide, Mercaptane, Thioether und Thiophene.
Die Autoren sind sich uneins darüber, ab welcher Temperatur die thermochemische Sulfatreduktion abläuft. Nach BILDSTEIN (2001) beträgt die Initialisierungstemperatur 120 °C bis 145 °C, nach GOLDSTEIN (1994) 175 °C, nach MACHEL (2001) 100 °C bis 140 °C und nach ORR (1974) 80 °C bis 100 °C.
Nach den Ergebnissen von CROSS (2004) beträgt die Aktivierungsenergie der Thermochemischen Sulfatreduktion 142 kJ/mol. Nach den Ergebnissen von CROSS (2004) beträgt die Sulfat-Halbwertszeit 1 – 4 Tage bei einer Temperatur von 325 °C bis 350 °C. Daraus resultiert nach Cross eine Sulfat-Halbwerteszeit von 23 – 1650 Jahren in typischen Gas-Reservoiren (150 °C – 200 °C) und von 1650 – 372000 Jahren in typischen Öl-Reservoiren (100 °C – 150 °C). Speziell für Gasreservoire ist die Reaktionsgeschwindigkeit der thermochemischen Sulfatreduktion so hoch, dass mehr Gas-Reservoire in geologischen Zeiträumen versauert sein sollten, als dies tatsächlich der Fall ist. Dies führt zu der Schlußfolgerung, dass die thermochemische Sulfatreduktion durch andere geschwindigkeitsbestimmende Schritte determiniert wird. Hierfür kommt nach MACHEL (1995) und WORDEN (2000) die Geschwindigkeit der Auflösung des Anhydrit (CaSO4) in Betracht. Allerdings sprechen eine begrenzte Zahl von Anhydrit-Lösungsexerperimenten (CROSS (1997)) gegen diese Hypothese. Als weitere Möglichkeit für einen geschwindigkeitsbestimmenden Schritt kommt nach ORR (1977) die Geschwindigkeit der Versorgung der Reaktionszone mit gelöstem Sulfat in Betracht. Nach BILDSTEIN (2001) und WORDEN (2000) kann auch die Ablagerung von Kalzit (CaCO3) auf dem Reaktanden Anhydrit (CaSO4) die Auflösung des Anhydrit behindern und somit der geschwindigkeitsbestimmende Schritt werden. Schließlich kann nach CROSS (2004) und GOLDSTEIN (1994) die Anwesenheit reduzierter Schwefel-Spezies essentiell für den Ablauf der thermochemischen Sulfatreduktion sein. Diese Hypothese könnte nach Cross (2004) das stark unterschiedliche Auftreten der thermochemischen Sulfatreduktion in Erdöl-Lagerstätten erklären, in denen reduzierte Schwefel-Spezies entweder fehlen, wie etwa in klastischen Rotliegend-Sedimenten oder vorhanden sind, etwa als elementarer Schwefel aus vorheriger biologischer Sulfatreduktion (BSR) oder in Sulfid-Mineralen.
2.3 Partialoxidation von Kohlenwasserstoffen
Jedes Sauerstoff-Atom hat im Grundzustand sechs Valenzelektronen auf dem zweiten Hauptenergieniveau. Die zwölf Valenzelektronen eines O2-Sauerstoffmoleküls werden auf die vier bindenden (σs, σx, πy und πz) und drei der vier antibindenden Molekülorbitale (σs*, πy*, πz*) verteilt. Da zwei antibindende Orbitale mit nur einem Elektron besetzt sind, resultiert eine Doppelbindung.
Di-Sauerstoff hat im Grundzustand, einem Triplettzustand, gemäß der Hund’schen Regel zwei ungepaarte Elektronen parallelen Spins. Durch diese Elektronenverteilung lässt sich der Paramagnetismus und der diradikalische Charakter des Sauerstoffs erklären. Interessanterweise senkt der Diradikalcharakter die Reaktionsfähigkeit, da eine konzertierte Reaktion der Spinerhaltung widersprechen würde. Besonders reaktionsfähig ist der angeregte Singulett-Sauerstoff. Eine weitere Folge der MO-Besetzung ist, dass es für O2 schwierig ist, eine korrekte Lewis-Formel anzugeben. Entweder wird der Diradikalcharakter vernachlässigt oder die Doppelbindung. Man kann daher zwei mesomere Grenzformen des Sauerstoffs in der Lewis-Schreibweise skizzieren, wie in Gl. (55) dargestellt.
(55)
Der diradikalische Charakter ermöglicht den Ablauf von Radikal-Kettenreaktionen, wie z.B. der Autoxidation von Kohlenwasserstoffen, siehe Gln. (56 – 63), vergleiche OLAH (1995). Autoxidation bezeichnet eine Oxidation durch Luftsauerstoff. Die Autoxidation verläuft sehr langsam und ohne merkliche Wärmeentwicklung oder Flammenerscheinung, im Gegensatz zur Verbrennung. Dabei werden aus Kohlenwasserstoffen zunächst Hydroperoxide (ROOH) gebildet, die langsam zu Alkoholen, Aldehyden, Ketonen und Carbonsäuren weiterreagieren können. Die Reaktion wird durch Licht, insbesondere ultraviolettes Licht, und Spuren von Metallen wesentlich beschleunigt. Die Autoxidation von Kohlenwasserstoffen ist eine Radikalkettenreaktion, bei der eine Vielzahl von unterschiedlichen Teilreaktionen abläuft. Ist ein Initiator vorhanden, reagiert ein Initiatorradikal mit Sauerstoff unter Bildung eines Peroxyradikals (Gl. 57). Dieses Peroxyradikal abstrahiert ein Wasserstoffatom aus einer Alkylkette, was zu einem Hydroperoxid und einem Alkylradikal führt (Gl. 58). Das Alkylradikal reagiert wiederum mit Sauerstoff zu einem Peroxyradikal (Gl. 57). Durch diesen Prozess werden zunächst Hydroperoxide (ROOH) gebildet, die unter Bruch der O–O-Bindung zu je einem Alkoxyradikal und Hydroxyl-Radikal (OH•) zerfallen können (Gl. 59). Diese Radikale können weitere H-Atome vom Substrat abstrahieren und dadurch Alkohol (ROH) (Gl. 60) bzw. Wasser (H2O) (Gl. 61) und Alkylradikale bilden. Letztere reagieren wiederum mit Sauerstoff zu Peroxyradikalen (Gl. 57). Weil durch diesen Prozess die quasistationäre Konzentration der Kettenträger (Peroxylradikale ROO•) ansteigt, laufen Autoxidationen bei hoher ROOH-Konzentration schneller ab. Autoxidation ohne Initiator könnte ebenfalls auftreten. Dieser Prozess ist durch eine Induktionsperiode und eine wesentlich geringere Reaktionsgeschwindigkeit gekennzeichnet, da die Bildung von Alkylradikalen gemäß Gl. (56) thermodynamisch und kinetisch unvorteilhaft ist, siehe OLAH (1995).
+ (56)
(57)
(58)
(59)
(60)
(61)
(60)
(62)
(63)
Das Produkt einer solchen Autoxidation wäre in diesem Fall ein Alkohol. Ketone werden bei einfachen Substraten (z.B. Cyclohexan) nicht durch Primärreaktionen, sondern durch sekundäre Weiterreaktionen mit ROOH, gebildet. Das zwischenzeitlich auftretende Radikal K•OOH ist nicht stabil: Es eliminiert ein Hydroxylradikal und wird zum Keton KO. Der Alkohol (ROH) kann in einer anschließenden Käfigreaktion (reaktive Teilchen dicht beieinander) gebildet werden, siehe Gln. 64-65, vgl. HERRMANNS (2005)
(64)
(65)
Alkane mit zwei tertiären C-H-Bindungen in oder -Position können Dihydroxoperoxide bilden. Das Produkt wird durch einen intramolekularen Peroxyradikal-Angriff gebildet, der bei der Umsetzung von 2,4-Dimethylpentan sehr effektiv ist (Gl. 66), siehe OLAH (1995).
Die Autoxidation von Alkanen kann durch katalytische Prozesse beschleunigt werden. Die Metall-Ionen nehmen dabei an allen Oxidationsvorgängen teil. Ihre Hauptrolle in der Autoxidation ist nicht die Fähigkeit, freie Radikale durch Elektronenübertragung zu generieren (siehe Gl. 67), sondern ihre Fähigkeit den homolytischen Bindungsbruch der Hydroperoxide zu katalysieren, siehe Gln. 68 und 69. Als ein Resultat dieser Zersetzung erzeugen Metall-Ionen Radikale, die die Kettenreaktion initialisieren. Die Gesamtreaktion ist in Gl. 70 dargestellt.
(67)
(68)
(69)
(70)
Da die Kohlenwasserstoffe im Salzstock Gorleben mit Metall-Ionen in Kontakt stehen, muss dort mit solchen katalytischen Prozessen gerechnet werden.
Die Produkte einer Partialoxidation von Kohlenwasserstoffen können beispielsweise Alkohole (siehe Gl. (71)), Aldehyde (siehe Gl. (72)), Ketone (siehe Gl. (73)), Carbonsäuren (siehe Gl. (74)), aber auch Ether, Oxirane, Ester und andere partiell oxidierte Kohlenwasserstoffe sein.
+ ½ O2 (71)
+ O2 + H2O (72)
+ O2 + H2O (73)
+ 1,5 O2 + H2O (74)
2. 4 Totaloxidation von Kohlenwasserstoffen
Neben der Partialoxidation von Kohlenwasserstoffen kann auch die Totaloxidation auftreten. Bei der Totaloxidation von Kohlenwasserstoffen entstehen Kohlenstoffdioxid (CO2) und Wasser (H2O) als die Produkte. Dies ist am Beispiel der Totaloxidation von Octan in Gl. (75) dargestellt:
(75)
Dieser Prozess läuft normalerweise in Form einer Verbrennung unter großer Wärmeentwicklung bei hohen Temperaturen ab. Es ist aber auch denkbar, dass eine Totaloxidation bei geringen Temperaturen auftritt. Wenn sich durch eine Partialoxidation von Kohlenwasserstoffen Carbonsäuren gebildet haben, können diese decarboxylieren, siehe Gl. (76):
(76)
Bei der Decarboxylierung von Carbonsäuren wird Kohlenstoffdioxid als Produkt gebildet. Besonders leicht läuft die Decarboxylierung von Carbonsäuren, wenn Radiakal-Initiatoren in der Reaktionsmischung vorhanden sind. Das dabei gebildete Carboxylradiakal decarboxyliert sofort. Bei der Hunsdiecker-Reaktion (siehe ATKINS XXX) wird Brom als Radikal-Initiator zugegeben, siehe Gl. (77):
(77)
Bei der Kolbe-Elektrolyse (siehe ATKINS XXX) erfolgt die Bildung des Carboxyl-Radikals durch anodische Oxidation, siehe Gl. (78):
(78)
Im vorliegenden Fall wird ein Reaktionssystem betrachtet, in dem auch das Cracking von Kohlenwasserstoffen auftritt. Dabei handelt es sich um eine Radikalkettenreaktion, siehe Gln. (2 – 39). Daher erscheint es naheliegend, dass eine Decarboxylierung von Carbonsäuren auftreten kann, da sich genügend Radikale als Initiatoren in der Reaktionsmischung befinden.
2.5 Folgereaktionen der Partialoxidation und der Totaloxidation von Kohlenwasserstoffen
Eine Folge der Partialoxidation und der Totaloxidation von Kohlenwasserstoffen ist die Ausbildung eines sauren Millieus. Bei der Totaloxidation von Kohlenwasserstoffen entstehen Kohlenstoffdioxid und Wasser als Produkt, siehe Gl. (75). Kohlenstoffdioxid und Wasser reagieren ihrerseits zu Kohlensäure, einer mittelstarken zweiprotonigen Säure mit einer Säurestärke vergleichbar etwa Essigsäure oder Zitronensäure, siehe Gl. (79).
(79)
Der pks1 von Kohlensäure beträgt 6,35 und der pks2 10,33 (siehe HOLLEMANN-WIBERG (2007)).
Aber auch die Produkte einer Partialoxidation der Kohlenwasserstoffe tragen zur Ausbildung eines sauren Millieus bei, da unter anderem Carbonsäuren als Produkte der Partialoxidation entstehen, siehe Gl. (74). Essigsäure hat beispielsweise einen pks-Wert von 4,75, siehe JANDER (2003).
Da der Einlagerungsbereich des Salzstocks Gorleben überwiegend aus NaCl mit Anhydrit-Einschaltungen von ungefähr 5 % besteht, können schwache Säuren wie Kohlensäure oder Carbonsäuren (z.B. Essigsäure) auch starke Säuren freisetzen. Aus NaCl kann am Beispiel von Kohlensäure gemäß Gl. (80) Salzsäure (HCl) freigesetzt werden und aus CaSO4 kann, ebenfalls am Beispiel von Kohlensäure, gemäß Gl. (81) Schwefelsäure (H2SO4) freigesetzt werden.
(80)
(81)
Da der pks von Salzsäure (HCl) einen Wert von -6 aufweist und der pks von Schwefelsäure (H2SO4) einen Wert von -3 (beides siehe JANDER (2003)), liegt das Gleichgewicht der Reaktionsgleichungen (80) und (81) ganz auf der linken Seite. Da Salzsäure und Schwefelsäure jedoch sehr reaktive Verbindungen sind, die z.B. mit dem Behältermaterial eines Atommüll-Endlagers weiterreagieren können und somit verbraucht würden, kann aus den Gleichgewichten in Gl. (80) und (81) stets Salzsäure und Schwefelsäure nachgebildet werden.
2.6 Folgereaktionen des Crackings und der Partialoxidation und Totaloxidation von Kohlenwasserstoffen: Halogenierung, Sulfonierung und Sulfatierung von Kohlenwasserstoffen
Beim Cracking von Kohlenwasserstoffen entstehen aus stöchiometrischen Gründen ungesättigte Kohlenwasserstoffe, siehe Gl. (1). Weiterhin können durch pericyclische Reaktionen auch aromatische Kohlenwasserstoffe als Produkte entstehen. Bei der Totaloxidation von Kohlenwasserstoffen entstehen Kohlenstoffdioxid (CO2) und Wasser (H2O) als Produkte. Daraus kann sich Kohlensäure (H2CO3) bilden, siehe Gl. (79). Bei der Partialoxidation von Kohlenwasserstoffen werden Carbonsäuren, wie z.B. Essigsäure (CH3COOH) gebildet. Diese schwachen Säuren können in Anwesenheit von NaCl Salzsäure freisetzen (siehe Gl. (80)). Damit sind die Voraussetzungen für die Halogenierung von Kohlenwasserstoffen erfüllt, diese ist am Beispiel von Gl. (81) am Beispiel der Chlorierung von 1-Buten dargestellt:
+ HCl (81)
Da eine Folgereaktion der Totaloxidation und der Partialoxidation von Kohlenwasserstoffen auch die Freisetzung von Schwefelsäure ist, siehe Gl. (81), ist es auch denkbar, dass eine Sulfonierung von Kohlenwasserstoffen erfolgen kann. Dabei werden sog. Sulfonsäuren gebildet, siehe Gl. (82):
(82)
Weiterhin können auch organische Schwefelsäureester, sogenannte Sulfate gebildet werden, dieser Prozess wird als Sulfatierung bezeichnet, siehe Gl. (83). Ausgangspunkt einer Sulfatierung ist ein Alkohol, der bei der partiellen Oxidation von Kohlenwasserstoffen gebildet werden kann, siehe Gl. (71). Dieser Alkohol kann mit Schwefelsäure (H2SO4) zu einem organischen Sulfat reagieren, siehe Gl. (83):
+ H2SO4 + H2O (83)
3 Experimentelles Vorgehen
3.1 Einleitung
Die Reaktionsbedingungen bei der Einlagerung von radioaktivem Abfall sind im Labor nicht vollständig nachstellbar. Wesentliche Einflußgrößen auf den Umsatz chemischer Reaktionen sind der Druck, die Temperatur und die Reaktionsdauer. Der Umsatz einer chemischen Reaktion ist definiert als der Anteil der umgesetzten Menge einer Komponente i bezogen auf die eingesetzte Menge , siehe Gl. (84):
(84)
In der Gl. (84) bezeichnet die Stoffmenge der Komponente , die noch vorhanden ist. Unter Einlagerungsbedingungen muss über einen Zeitraum von mehreren zehntausend Jahren mit einer auf bis zu 200 °C erhöhten Temperatur gerechnet werden, siehe Abb. 1. Dieses Szenario liegt vor aufgrund des Wärme entwickelnden radioaktiven Abfalls. Reaktionsdauern von mehreren zehntausend Jahren sind im Labor nicht nachstellbar. Eine Möglichkeit, sich experimentell längeren Reaktionsdauern anzunähern, ist eine erhöhte Reaktionstemperatur, da die Geschwindigkeit chemischer Reaktionen mit der Temperatur ansteigt. Für die Reaktionsgeschwindigkeit einfacher chemischer Reaktionen gelten die nachfolgenden Gleichungen:
Für eine Reaktion nullter Ordnung:
(85)
Für eine Reaktion erster Ordnung:
(86)
Für eine Reaktion zweiter Ordnung:
(87)
Für eine Reaktion zweiter Ordnung bei der Umwandlung nur eines Stoffes:
(88)
Die Temperaturabhängigkeit der Reaktionsgeschwindigkeitskonstante einer Reaktion zweiter Ordnung wird durch die Eyring-Gleichung beschrieben, siehe MOORE (1986):
(89)
Hierin ist der Transmissionskoeffizient, die Boltzmann-Konstante, das Planck´sche Wirkungsquantum, die Zustandssumme je Volumeneinheit des aktivierten Komplexes (Übergangszustand), die Zustandssumme je Volumeneinheit des Moleküls A, die Zustandssumme je Volumeneinheit des Moleküls B, die Höhe des niedrigsten Energieniveaus des Komplexes über der Summe der niedrigsten Energieniveaus der Reaktanden A und B und die Temperatur [K].
Für die Temperaturabhängigkeit der Geschwindigkeitskonstante chemischer Reaktionen gibt es aber auch empirische Ansätze. Wenn man die Temperaturabhängigkeit der Geschwindigkeitskonstanten vieler Reaktionen untersucht, stellt man fest, dass sehr viele von ihnen der Arrhenius-Gleichung gehorchen, siehe ATKINS (2001):
(90)
In dieser Gleichung ist der präexponentielle Faktor oder Frequenzfaktor, die Aktivierungsenergie, die universelle Gaskonstante und die Temperatur [K].
3.2 Experimentelle Methodik
Die Versuche wurden in Goldkapseln durchgeführt. Diese Kapseln weisen eine Länge von 35 mm und einen Innendurchmesser von 4 mm oder 4,6 mm auf. Die Kapseln werden aus Goldrohr hergestellt, das hierfür zunächst in 35 mm lange Stücke geschnitten wird. Die Rohrabschnitte werden zur Reinigung zunächst in Aceton geschwenkt. Anschließend werden die Kapseln in einen Porzellantiegel überführt und in einem Muffelofen für 10 Minuten bei 750 °C geglüht. Danach werden die Kapseln in destilliertem Wasser abgeschreckt und im Trockenschrank für 30 Minuten bei 105 °C getrocknet. Danach werden die Rohrabschnitte mit einer Flachzange einseitig zugequetscht und die Kante wird mit einer Schere glatt abgeschnitten. Anschließend werden die Kapseln einseitig mit einem Lichtbogen-Schweißgerät (Lampert Werktechnik GmbH, Modell PUK3 professional plus) verschweißt. Die leeren Kapseln werden ausgewogen. Die halbseitig geschlossenen Kapseln werden nun mit einer abgewogenen Menge an Salz befüllt und erneut ausgewogen. Aus der Gewichtsdifferenz wird die Salzeinwaage in der Kapsel ermittelt. Dann werden die Kapseln mit Wasser und ggf. mit n-Octan als Modell-Kohlenwasserstoff befüllt. Die Befüllung erfolgt entweder unter einer Luftatmosphäre oder in einer Glovebox unter einer Stickstoffatmosphäre. Die offene Seite der Goldkapseln wird in der Glovebox oder an der Luft mit einer Flachzange zugequetscht. Anschließend wird die Kante mit einer Schere abgeschnitten und die Kapseln werden mit dem Lichtbogenschweißgerät zugeschweißt. Die Kapseln werden danach erneut gewogen. Es erfolgt dann eine Dichtigkeitsprüfung der Kapseln, hierfür kommen sie für ca. 30 Minute bei 105 °C in den Trockenschrank und werden danach gewogen. Die Dichtheit der Kapseln wird über etwaige Massendifferenzen abgeschätzt.
Die gefüllten Goldkapseln werden dann in einen Träger überführt und werden in den Hochdruckreaktor (Parr Instrument Company, Modell 4763) eingebracht. Nach Beendigung der Reaktion wird der Träger mit den Kapseln aus dem Hochdruckreaktor entfernt und die Kapseln werden nacheinander in Wasser, Aceton und Dichlormethan gereinigt. Danach wird jede Kapsel in ein Headspace-Vial überführt und das Vial wird verschlossen. Mit einer Ale werden die Goldkapseln durch das Septum des Headspace-Vials hindurch angestochen. Die Analyse erfolgt mit Gaschromatographen, die mit verschiedenen Detektoren ausgerüstet sind. Alle Versuche wurden doppelt durchgeführt. Es hat sich dabei herausgestellt, dass die Wiederholbarkeit der Ergebnisse schwankend ist. Eine mögliche Erklärung dafür ist die mangelhafte Durchmischung in den Goldkapseln. Gab es bei Methan als Produkt Abweichungen von größer als 100 % zwischen den Doppelversuchen, wurden die Versuchsergebnisse verworfen. Ansonsten wurden die Ergebnisse aus den Doppelversuchen gemittelt.
3.3 Wahl der Reaktionsbedingungen
Unter Einlagerungsbedingungen tritt eine Temperatur von bis zu 200 °C über einen Zeitraum von mehreren zehntausend Jahren auf, siehe Abb. 1. Solche Reaktionsdauern sind im Labor nicht nachstellbar. Daher musste eine höhere Reaktionstemperatur gewählt werden, da die Umsätze ansonsten unrealistisch klein würden. Die Reaktionsdauer wurde auf 17 Tage festgelegt. Geht man von der empirischen Arrhenius-Gleichung (Gl. (90)) aus, dann würde für die Initialisierungsreaktion des Crackings von Ethan mit einer Aktivierungsenergie von 87,5 kcal/mol entsprechend 366,3 kJ/mol (siehe ALLARA (1980)) die simulierte Reaktionsdauer 3809273 Jahre betragen. Für die Thermochemische Sulfatreaktion haben CROSS et al. (2004) eine Aktivierungsenergie von 142 kJ/mol errechnet. Die in unseren Experimenten simulierte Reaktionsdauer würde 54 Jahre betragen. Man kann erkennen, dass die höher gewählte Reaktionstemperatur zu stark unterschiedlichen simulierten Reaktionsdauern führt, abhängig von der Aktivierungsenergie der chemischen Reaktion. Ein weiterer Nachteil der höher gewählten Reaktionstemperatur ist das mögliche Auftreten von weiteren Reaktionen, Nebenreaktionen oder anderen Reaktionswegen.
Der Gebirgsdruck im geplanten Einlagerungsbereich im Salzstock Gorleben beträgt etwa 180 bar bis 190 bar, siehe BRÄUER (2012). Die Versuche wurden im Hochdruckreaktor bei einem Druck von 105 bar bzw. 120 bar durchgeführt. Allerdings ist nicht sichergestellt, dass der Druck in den Goldkapseln in allen Experimenten diesen Wert erreichte. Dies liegt daran, dass die Kapseln mit Salz gefüllt sind. Die Salzschüttung in den Kapseln weist eine Porosität von geschätzt 50 % auf. Wenn die Goldkapseln im Hochdruckreaktor kollabieren, ist der Porenraum der Schüttung in den Kapseln mit Gas gefüllt, sofern nicht Wasser als Reaktand zugesetzt wurde, der den Porenraum ausfüllt. In vielen Experimenten wurde eine Salzmasse von 75 mg zugegeben. Mit einer Dichte von Salz von 2,16 g/cm3 erhält man daraus mit einer angenommenen Porosität von 50 % ein Porenvolumen von 0,035 cm3. Das Volumen in der Goldkapsel, deren freie Länge ca. 2 cm und deren Innendurchmesser ca. 4 mm beträgt, ist 0,33 cm3. Daher würde sich bei einer vollständig kollabierten Goldkapsel im Porenraum der Schüttung ein Druck von nur 9,58 bar einstellen.
Es wurden aber auch Experimente mit einer Salzmasse von 5 mg durchgeführt, bei diesen Experimenten beträgt das Porenvolumen 0,0023 cm3. Bei einem Innenvolumen der Goldkapsel von 0,33 cm3 ergäbe sich daraus bei einer vollständig kollabierten Goldkapsel ein Innendruck von 143,65 bar. Dieser Druck ist größer, als der Außendruck von 105 bar bzw. 120 bar, so dass man bei diesen Experimenten davon ausgehen kann, dass sich auch in der Goldkapsel der Außendruck im Hochdruckreaktor einstellt.
Weitere Experimente wurden mit einer Salzmasse von 20 mg durchgeführt, bei diesen Experimenten beträgt das Porenvolumen 0,0093 cm3. Bei einem Innenvolumen der Goldkapsel von 0,33 cm3 ergäbe sich daraus bei einer vollständig kollabierten Goldkapsel ein Innendruck von 35,91 bar. Dieser Druck ist kleiner, als der Außendruck von 105 bar bzw. 120 bar, so dass man bei diesen Experimenten davon ausgehen muss, dass sich im Porenraum nur ein Druck von ca. 36 bar einstellen konnte.
Es bleibt festzuhalten, dass die Einflussgrößen auf den Umsatz einer chemischen Reaktion, der Reaktionsdruck, die Reaktionstemperatur und die Reaktionsdauer in unseren Experimenten nur unzureichend nachgestellt werden konnten.
Erschwerend kommt hinzu, dass die Reaktionsmischung in den Goldkapseln nicht durchmischt wird. Es handelt sich bei den Goldkapseln also nicht um einen Absatz-Rührkesselreaktor. Aufgrund der unzureichenden Durchmischung sind diese Experimente daher nicht geeignet, kinetische Daten zu erheben, wie sie für eine Vorhersage über den Einlagerungszeitraum notwendig wären. Die Versuchsergebnisse sollen daher nur qualitativ, nicht aber quantitativ interpretiert werden.
4 Versuchsergebnisse
4.1 Totaloxidation von Kohlenwasserstoffen
In einer ersten Versuchsreihe wurden 5 µl bzw. 30,73 µmol Octan als Edukt verwendet. Die Reaktion fand sowohl in einer Luftatmosphäre, wie auch in einer Stickstoffatmosphäre statt und sowohl in Anwesenheit von Wasser, wie auch ohne Wasser. In Abb. 3 ist der Gehalt an Kohlenstoffdioxid sowohl in µmol als auch in Vol-% dargestellt.
Abb. 3: Gebildete Mengen an CO2 in den Hochdruckexperimenten unter
verschiedenen Atmosphären (ohne Salze), Octan (5 µl bzw. 30,73 µmol)
als Edukt, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Die Ergebnisse sind überraschend. Die Menge an gebildetem Kohlenstoffdioxid ist in allen Experimenten vergleichsweise hoch. Der Gehalt in der Atmosphäre der Goldkapseln beträgt zwischen ca. 10 Vol-% und ca. 20 Vol-% und zwar auch in einer Stickstoffatmosphäre. Daher bestand zunächst der Verdacht, dass es sich um eine Verunreinigung handeln könnte, doch der Kohlenstoffdioxidgehalt in der Luft beträgt nur ca. 0,04 Vol-%, so dass das CO2 nicht aus der Luft stammen kann. Daher wurde eine Versuchsreihe von Blindexperimenten ohne Zugabe von n-Octan als Modellkohlenwasserstoff durchgeführt. In keiner Probe aus dieser Serie von Experimenten konnte Kohlenstoffdioxid mit der vorhandenen Analytik nachgewiesen werden. Das Kohlenstoffdioxid aus der Versuchsreihe, die in Abb. 3 dargestellt ist, stammt also tatsächlich aus der Totaloxidation des n-Octan. Es ist allerdings ungeklärt, woher der Sauerstoff stammt, mit dem das n-Octan in einer Stickstoffatmosphäre oxidiert wurde. Die gebildete Menge an Kohlenstoffdioxid liegt unter einer Stickstoffatmosphäre in derselben Größenordnung, wie unter einer Luftatmosphäre. Dies ist ein Hinweis darauf, dass in unseren Experimenten keine reine Stickstoffatmosphäre hergestellt werden konnte. Die Goldkapseln wurden in der Glovebox nur mit einer Zange zugeklemmt, aber unter einer Luftatmosphäre verschweißt. Vielleicht ist dabei wieder Luft in die Kapseln gelangt.
Als Ergebnis dieser Experimente bleibt festzuhalten, dass n-Octan unter den gewählten Reaktionsbedingungen zu Kohlenstoffdioxid oxidiert wird. Dies geschieht bei einer relativ moderaten Temperatur von 315 °C und ohne Ausbildung einer Flamme. Wasser hat auf die gebildete Menge an Kohlenstoffdioxid einen untergeordneten oder keinen Einfluss.
Um zu prüfen, ob Salze einen katalytischen Einfluss auf die Totaloxidation von n-Octan haben, wurde eine Versuchsreihe durchgeführt, in der chemisch reine Salze, aber auch aufgemahlenes Salz aus dem Salzstock Gorleben der Reaktionsmischung zugefügt wurde. Die Ergebnisse dieser Versuchsreihe, die unter einer Luftatmosphäre durchgeführt wurde, sind in Abb. 4 dargestellt:
Abb. 4: Gebildete Mengen an CO2 in den Hochdruckexperimenten in Anwesenheit
verschiedener Salze (75 mg), Octan (5 µl bzw. 30,73 µmol) als Edukt in einer
Luftatmosphäre ohne Wasser, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Zunächst ist festzuhalten, dass die Menge des gebildeten CO2 für alle Salze in derselben Größenordnung liegt. Die Größenordnung ist auch dieselbe, wie in Abwesenheit von Salzen, vgl. Abb. 3. Allerdings ist es so, dass die Salze alle eine sehr geringe BET-Oberfläche aufweisen, so dass nach den Erfahrungen aus der heterogenen Katalyse auch kaum ein katalytischer Einfluss erwartet werden kann. Die BET-Oberfläche des MgCl2 beträgt 6,2 m2/g, die des Na2SO4 beträgt 0,2 m2/g, die des NaCl beträgt 0,1 m2/g und die der gemörserten Probe RB 644H aus dem Salzstock Gorleben 2,6 m2/g. Allerdings fällt auf, dass in Anwesenheit von Salz aus dem Salzstock Gorleben etwa doppelt so viel Kohlenstoffdioxid gebildet wurde, wie in Anwesenheit der chemisch reinen Salze. Eine mögliche Ursache hierfür ist die Zersetzung von Carbonaten aus dem Salz des Salzstockes Gorleben. Um dies zu prüfen, wurden Proben dieses Salzes in einem Headspace-Vial mit 12 %iger und 1,2 %iger Phosphorsäure angesäuert und die entstehenden Gase untersucht. Dabei hat sich herausgestellt, dass durch die Zugabe von Phosphorsäure in beiden Experimenten etwa 300 ppm Kohlenstoffdioxid in die Atmosphäre freigesetzt wurden. Dies spricht dafür, dass das Salz aus dem Salzstock Gorleben tatsächlich Carbonate enthält, die durch Erhitzung zersetzt werden und wobei CO2 freigesetzt wird. In einem Blindexperiment wurde Wasser zu einer aufgemahlenen Salzprobe der Bohrung RB 644H zugesetzt, dabei konnte kein Kohlenstoffdioxid in der Atmosphäre nachgewiesen werden.
In einer weiteren Versuchsreihe wurde der Reaktionsmischung nur Salz der Bohrung RB 644H aus dem Salzstock Gorleben zugesetzt. Die Reaktion fand sowohl mit n-Octan als Modellkohlenwasserstoff, wie auch ohne n-Octan und mit Wasser, wie auch ohne Wasser statt. Die Experimente wurden in einer Stickstoffatmosphäre durchgeführt. Die Ergebnisse dieser Versuchsreihe sind in Abb. 5 dargestellt:
Abb. 5: Gebildete Mengen an CO2 in den Hochdruckexperimenten in Anwesenheit
von Gorleben-Salz (75 mg), mit und ohne Octan (5 µl bzw. 30,73 µmol) in einer
N2-Atmosphäre, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Es ist überraschend, dass die größte Menge an Kohlenstoffdioxid in Anwesenheit des Salzes der Bohrung RB 644H ohne n-Octanzugabe gebildet wurde. Dies unterstützt die Hypothese, dass das Salz des Salzstockes Gorleben Carbonate enthält, die in unseren Experimenten thermisch zersetzt wurden. Mit n-Octan als Modellkohlenwasserstoff wurde weniger CO2 gebildet, dieses Ergebnis ist logisch nicht nachvollziehbar, da n-Octan unter den gewählten Reaktionsbedingungen ohne Zugabe von Salzen einer Totaloxidation unterliegt, siehe Abb. 3. Möglicherweise ist das Ergebnis auf eine mangelhafte Wiederholbarkeit der Experimente zurückzuführen, die ihrerseits ihren Grund in einer mangelhaften Durchmischung in den Goldkapseln haben kann. In Anwesenheit von Wasser wurde Kohlenstoffdioxid in derselben Größenordnung gebildet, wie ohne Wasser. Wasser hat also weder einen fördernden, noch einen hemmenden Einfluss auf die Bildung von CO2 in unseren Experimenten.
4.2 Partialoxidation von Kohlenwasserstoffen
In einer ersten Versuchsreihe wurde untersucht, wie viel Ketone sich in Anwesenheit von chemisch reinem NaCl unter einer Luftatmosphäre und unter einer Stickstoffatmosphäre bilden. Die Ergebnisse sind in Abb. 6 dargestellt:
Abb. 6: Gebildete Mengen an Ketonen (Aceton und Butanon) in den Hochdruck-
experimenten in Anwesenheit von NaCl (75 mg) unter verschiedenen Atmosphären,
Octan (5 µl bzw. 30,73 µmol) als Edukt, T = 315 °C, p = 105 bar, Reaktionsdauer 17
Tage.
Zunächst ist festzuhalten, dass nur Aceton und Butanon in der Analytik kalibriert waren, so dass eventuell weitere bei den Versuchen entstandene Ketone nicht erfasst werden konnten. Weiterhin fällt auf, dass die Wiederholbarkeit der Experimente schlecht ist. Die Fehlerbalken im Diagramm zeigen die Abweichung im Doppelversuch, allerdings wurden die Doppelversuche wiederholt und dabei hat sich herausgestellt, dass die Abweichung in der Größenordnung von 100 % liegt. Hierzu können die ersten beiden Säulen in Abb. 6 und die letzten beiden Säulen in derselben Abbildung verglichen werden. Generell ist festzustellen, dass sich in allen Experimenten Ketone gebildet haben. Überraschend ist, dass dies auch unter einer Stickstoffatmosphäre geschah, was ein Hinweis darauf sein kann, dass es nicht gelungen ist, Sauerstoff in den Goldkapseln ganz zu vermeiden. Aufgrund der schlechten Wiederholbarkeit der Experimente ist ein Vergleich der gebildeten Mengen an Ketonen zwischen einer Stickstoffatmosphäre und einer Luftatmosphäre problematisch. Bei der Totaloxidation von Kohlenwasserstoffen war kein wesentlicher Unterschied bei der gebildeten Menge an CO2 zwischen einer Luft- und einer Stickstoffatmosphäre festzustellen, siehe Abb. 3. Bei der Partialoxidation hat es den Anschein, dass die gebildete Menge an Ketonen unter einer Luftatmosphäre möglicherweise größer ist, als unter einer Stickstoffatmosphäre, aber die schlechte Wiederholbarkeit der Experimente macht eine sichere Aussage zu dieser Fragestellung nicht möglich.
In einer zweiten Versuchsreihe wurde die Menge der gebildeten Ketone in Anwesenheit von gemörsertem Salz aus der Bohrung RB 644 aus dem Salzstock Gorleben untersucht. Die Experimente fanden in einer Stickstoffatmosphäre statt und zusätzlich wurde der Einfluss von Wasser auf die gebildete Menge an Ketonen untersucht. Die Ergebnisse sind in Abb. 7 dargestellt:
Abb. 7: Gebildete Mengen an Ketonen (Aceton und Butanon) in den Hochdruck-
experimenten in Anwesenheit von Gorleben-Salz (75 mg) in einer N2-Atmosphäre
mit/ohne Wasserzugabe, mit und ohne Octan (5 µl bzw. 30,73 µmol) als Edukt,
T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Als erstes Ergebnis kann festgehalten werden, dass ohne Zugabe von n-Octan als Modell-Kohlenwasserstoff keine Ketone detektiert wurden. Daraus kann die Schlussfolgerung abgeleitet werden, dass das natürliche Kohlenwasserstoff-Inventar in diesem Salz nicht zur Bildung von Ketonen bei Aufheizexperimenten beiträgt. Als zweites wesentliches Ergebnis kann aus dem Experiment die Schlussfolgerung abgeleitet werden, dass in Anwesenheit von Wasser mehr Ketone gebildet werden, als ohne Wasser. Ob das Wasser dabei selbst als Oxidationsmittel dient oder ob andere Reaktionswege und Reaktionsmechanismen beschritten werden, kann anhand der vorliegenden Experimente nicht geklärt werden.
In einer dritten Versuchsreihe wurde der Einfluss verschiedener Salze auf die Menge der gebildeten Ketone untersucht. Die Experimente fanden unter einer Luftatmosphäre statt. Die Ergebnisse sind in Abb. 8 dargestellt:
Abb. 8: Gebildete Mengen an Ketonen (Aceton und Butanon) in den Hochdruck-
experimenten in Anwesenheit verschiedener Salze (75 mg) mit Octan (5 µl bzw.
30,73 µmol) als Edukt, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Zunächst fällt in dieser Experimentserie wieder die schlechte Wiederholbarkeit der Ergebnisse auf. Hierzu kann man die erste und die zweite Säule in der Abb. 8 vergleichen. Bei beiden Experimenten handelt es sich um einen Versuch in Anwesenheit von NaCl unter denselben experimentellen Bedingungen, die Abweichungen betragen aber etwa 100 %. Eine Ursache hierfür kann in der mangelnden Durchmischung in der Goldkapsel liegen, aber auch Fehler beim Anstechen der Kapseln im Headspace-Vial sind eine denkbare Ursache für die schlechte Wiederholbarkeit. Eine Interpretation der Ergebnisse sollte daher nur mit Vorsicht erfolgen. Als wichtigstes Ergebnis kann aber festgehalten werden, dass in dem Vergleichsexperiment ohne Zugabe von Salzen etwa dieselbe Menge an Ketonen gebildet wurde, wie in Anwesenheit verschiedener Salze. Ob es tatsächlich einen katalytischen Einfluss der Salze auf die Bildung von Ketonen gibt oder ob es sich bei den Unterschieden um die Streuung der experimentellen Ergebnisse handelt, kann bisher nicht geklärt werden.
4.3 Cracken von Kohlenwasserstoffen
In einer ersten Versuchsreihe wurde der Einfluss verschiedener Atmosphären und der Einfluss von Wasser auf das Cracken von n-Octan als Modell-Kohlenwasserstoff untersucht. Salze waren bei diesen Experimenten nicht Teil der Reaktionsmischung. Die Ergebnisse sind in Abb. 9 dargestellt:
Abb. 9: Stoffmenge der gebildeten Cracking-Produkte von n-Octan (5 µl bzw.
30,73 µmol) als Funktion der Kettenlänge unter verschiedenen
Atmosphären, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Bei einigen Versuchen war n-Butan nicht im Headspace-GC mit Flammenionisationsdetektor kalibriert, so dass für diese Verbindung keine gebildete Stoffmenge angegeben werden kann. Als erstes Ergebnis ist festzustellen, dass das Cracken von n-Octan unter den gewählten Reaktionsbedingungen in allen Experimenten beobachtet wurde. Die Hauptprodukte sind kleine Kohlenwasserstoffmoleküle wie Methan, Ethan und Propan. Mit dieser Reaktion geht also eine deutliche Volumenzunahme einher und damit ein Druckaufbau in einem geschlossenen System. Es hat den Anschein, dass Wasser einen hemmenden Einfluss auf das Cracken von n-Octan als Modell-Kohlenwasserstoff hat. Die geringste Menge an Produkten wurde in der Reaktionsmischung mit 75 µl Wasser unter einer Stickstoffatmosphäre gefunden. Allerdings ist zu bedenken, dass dieses Experiment aus einer anderen Experimentserie stammt. Möglicherweise liegt hier wieder das Problem einer schlechten Wiederholbarkeit vor. Falls dies nicht der Fall ist, könnte man die Schlussfolgerung ableiten, dass die Menge der gebildeten Cracking-Produkte in einer Stickstoff-Atmosphäre geringer ist, als in einer Luftatmosphäre, wenn Wasser in der Reaktionsmischung vorhanden ist. Ohne Wasser in der Reaktionsmischung ist die gebildete Menge an Cracking-Produkten in einer Stickstoff-Atmosphäre sehr ähnlich zu der in einer Luftatmosphäre.
In einer zweiten Versuchsreihe sollte ein etwaiger katalytischer Einfluss verschiedener Salze auf die gebildete Menge und die Produktverteilung des Crackens von n-Octan als Modell-Kohlenwasserstoff untersucht werden. Alle Experimente fanden unter einer Luftatmosphäre statt, Wasser wurde der Reaktionsmischung nicht zugegeben. Die Ergebnisse dieser Versuchsreihe sind in Abb. 10 dargestellt:
Abb. 10: Stoffmenge der Cracking-Produkte von n-Octan (5 µl bzw. 30,73 µmol) als
Funktion der Kettenlänge in Anwesenheit verschiedener Salze (75 mg) in einer
Luftatmosphäre, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Als erstes Ergebnis ist festzustellen, dass die Menge der gebildeten Produkte in einer ähnlichen Größenordnung liegt, wie ohne Salze in der Reaktionsmischung, vergl. Abb. 9. Auch die Verteilung der Kettenlängen der Produkte ähnelt dem Experiment ohne Salze in der Reaktionsmischung. Diese Befunde sind allerdings wenig überraschend, da die BET-Oberflächen der Salze sehr gering sind, so dass nach den Erfahrungen aus der heterogenen Katalyse kaum ein messbarer katalytischer Einfluss erwartet werden kann. Die BET-Oberfläche des MgCl2 beträgt 6,2 m2/g, die des Na2SO4 beträgt 0,2 m2/g, die des NaCl beträgt 0,1 m2/g und die der gemörserten Probe RB 644H aus dem Salzstock Gorleben 2,6 m2/g. Betrachtet man die Produktverteilung, so fällt auf, dass in Anwesenheit von Na2SO4 und dem Gemisch aus NaCl und Na2SO4 der größte Anteil an Methan bei den Produkten entstanden ist. Die insgesamt geringste Menge an Cracking-Produkten befand sich in der Reaktionsmischung, die gemörsertes Salz aus der Bohrung RB 644 aus dem Salzstock Gorleben enthielt.
In einer weiteren Versuchsreihe sollte der Einfluss des gemörserten Salzes aus der Bohrung RB 644 auf das Cracken von Kohlenwasserstoffen genauer untersucht werden. Zu diesem Zweck wurde das Salz ohne Zugabe von n-Octan untersucht, ebenso wie mit der Zugabe von n-Octan. Für beide Varianten wurde auch der Einfluss von Wasser untersucht. Die Untersuchungen wurden unter einer Stickstoffatmosphäre durchgeführt. Die Ergebnisse sind in Abb. 11 dargestellt:
Abb. 11: Stoffmenge der Cracking-Produkte in Anwesenheit von gemörsertem
Knäuelsalz (RB 644H, SBET = 2,6 m2/g, 75 mg) mit und ohne Octan (5 µl bzw.
30,73 µmol) als Modell-Kohlenwasserstoff, Stickstoff-Atmosphäre, T = 315 °C,
p = 105 bar, Reaktionsdauer 17 Tage.
Für einen Vergleich ist in Abb. 12 der Gehalt an natürlich vorkommenden Kohlenwasserstoffen in zwei Proben dargestellt, die der gemörserten Probe RB 644H nahe benachbart sind:
Abb. 12: Natürlicher Kohlenwasserstoffgehalt der Proben RB 644B und RB 644C, nahe
benachbart zur Probe RB 644H.
Zunächst fallt in Abb. 11 auf, dass ohne n-Octan als Modell-Kohlenwasserstoff nur eine geringe Menge an Kohlenwasserstoffen im Aufheizexperiment freigesetzt wurde: In dem Experiment ohne Wasser konnte Methan nachgewiesen werden. Ist Wasser anwesend, konnten überhaupt keine Kohlenwasserstoffe in der Gasatmosphäre nach dem Aufheizversuch nachgewiesen werden. Ein anderes Bild ergibt sich, wenn der Reaktionsmischung n-Octan als Modell-Kohlenwasserstoff zugesetzt wurde. In diesem Fall wurden sowohl in Anwesenheit von Wasser, als auch ohne Wasser Cracking-Produkte in der Gasphase identifiziert. Überwiegend sind bei diesem Experiment kurzkettige Kohlenwasserstoffe wie Methan, Ethan und Propan entstanden, was aufgrund der Molzahlzunahme zu einer Volumenzunahme und in einem geschlossenen System zu einem entsprechenden Druckaufbau führen würde. Es hat den Anschein, das in Anwesenheit von Wasser Methan das Hauptprodukt des Crackens von n-Octan ist, während ohne Wasser Ethan das Hauptprodukt ist. Aufgrund der schlechten Wiederholbarkeit unserer Experimente sollte eine solche Interpretation aber nur vorsichtig erfolgen.
4.4 Einfluss der Salzmenge auf das Cracken von Kohlenwasserstoffen
Nach den bisherigen Ergebnissen wird nicht eindeutig klar, ob die Salze, die der Reaktionsmischung zugesetzt wurden, einen katalytischen Einfluss auf das Cracken von Kohlenwasserstoffen haben. Um dies zu prüfen, wurde eine weitere Serie von Experimenten mit NaCl als Modellsalz durchgeführt. Bei diesen Experimenten wurde der NaCl-Gehalt in den Goldkapseln verändert. Wenn NaCl einen katalytischen Einfluss auf das Cracken von Kohlenwasserstoffen hat, kann man annehmen, dass dieser Einfluss mit zunehmender Salzmenge ansteigt. Allerdings müssen diese Experimente mit Vorbehalten interpretiert werden: Zum Einen ist die BET-Oberfläche des NaCl mit nur 0,1 m2/g sehr gering, so dass es nach den Erfahrungen aus der heterogenen Katalyse naheliegt, dass der Einfluss des Salzes generell zu gering ist, um messbar zu sein. Zum anderen verändert die Salzmenge auch den Reaktionsdruck. Da das Cracking aufgrund der Stöchiometrie der Produkte mit einer erheblichen Volumenzunahme einhergeht, die in einem geschlossenen System mit einer Druckzunahme einhergeht, ist anzunehmen, dass das Cracken von Kohlenwasserstoffen vom Reaktionsdruck abhängt. Die Abhängigkeit zwischen der Salzmenge und dem Reaktionsdruck ist im Kapitel 3.3 ausführlich diskutiert.
Abb. 12: Stoffmenge der Cracking-Produkte in Anwesenheit von NaCl mit Octan (5 µl
bzw. 30,73 µmol) als Modell-Kohlenwasserstoff, Luft-Atmosphäre, T = 315 °C,
p = 105 bar, Reaktionsdauer 17 Tage.
In einem ersten Experiment wurde der Einfluss der Salzmenge in einer Luftatmosphäre untersucht, siehe Abb. 12. Dabei hat sich herausgestellt, dass die Salzmenge keinen signifikanten Einfluss auf die Produktmenge und die Produktverteilung des Crackens von n-Octan als Modell-Kohlenwasserstoff hat. Die Kurven in Abb. 12 liegen dicht beieinander und die insgesamt geringste Menge an Cracking-Produkten findet sich in dem Ansatz mit der größten Salzmenge. Ein etwas anderes Bild ergibt sich für dasselbe Experiment, wenn es mit Wasser in der Reaktionsmischung durchgeführt wurde, siehe Abb. 13. Ist Wasser in der Reaktionsmischung vorhanden, füllt es den Porenraum und man kann davon ausgehen, dass in allen Experimenten der Außendruck von 105 bar auch in der Goldkapsel erreicht wurde. Überraschenderweise findet sich auch in diesem Experiment die geringste Menge an Cracking-Produkten in dem Ansatz mit der höchsten Salzmasse. Das Salz hat also keinen förderlichen katalytischen Einfluss auf das Cracken von n-Octan als Modell-Kohlenwasserstoff. Ob das Salz die Geschwindigkeit des Crackens gar verlangsamt, kann aufgrund der schlechten Wiederholbarkeit der Ergebnisse nicht mit Sicherheit gesagt werden.
Abb. 13: Stoffmenge der Cracking-Produkte in Anwesenheit von NaCl mit Octan (5 µl
bzw. 30,73 µmol) als Modell-Kohlenwasserstoff, Luft-Atmosphäre, mit Wasser,
T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Die Experimente wurden in einer Stickstoffatmosphäre wiederholt. Auch hier zeigt sich ein ähnliches Bild, siehe Abb. 14:
Abb. 14: Stoffmenge der Cracking-Produkte in Anwesenheit von NaCl mit Octan (5 µl
bzw. 30,73 µmol) als Modell-Kohlenwasserstoff, Stickstoff-Atmosphäre,
T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Die gebildete Menge an Cracking-Produkten liegt bei 5 mg Salzeinwaage in derselben Größenordnung, wie bei 75 mg Salzeinwaage. Bei der größeren Salzeinwaage wurden sogar etwas weniger Cracking-Produkte gebildet, als bei der geringen Salzeinwaage. Ein Einfluss des Druckes in der Goldkapsel aufgrund der unterschiedlichen Salzeinwaage kann ausgeschlossen werden, da das Cracken mit einer Molzahlzunahme einhergeht und somit mit einer Volumenvergrößerung. Das Cracken sollte also bei höherem Druck (geringe Salzeinwaage) langsamer erfolgen, als bei niedrigem Druck (große Salzeinwaage). In einer letzten Versuchsreihe wurde dieses Experiment mit einer Zugabe von Wasser wiederholt, die Ergebnisse sind in Abb. 15 dargestellt. In diesem Experiment ist der Druck in den Goldkapseln in beiden Fällen gleich, da das Wasser den Porenraum zwischen den Salzkristallen ausfüllt. Auch in diesem Experiment konnte kein dem Cracken förderlicher katalytischer Einfluss von NaCl nachgewiesen werden, es ist eher umgekehrt: In Anwesenheit der größeren Salzmenge ist die Menge an gebildeten Cracking-Produkten geringer. Man kann aufgrund der schlechten Wiederholbarkeit der Ergebnisse aus diesem Experiment jedoch nicht sicher ableiten, dass NaCl einen hemmenden Einfluss auf das Cracken von n-Octan ausübt.
Abb. 15: Stoffmenge der Cracking-Produkte in Anwesenheit von NaCl mit Octan (5 µl
bzw. 30,73 µmol) als Modell-Kohlenwasserstoff, Stickstoff-Atmosphäre,
mit Wasser, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Auch wenn dies nicht Ziel der Experimente war, lässt sich doch eine systematische Beobachtung anhand dieser Experimente tätigen: In allen Fällen ist die gebildete Menge an Cracking-Produkten in Anwesenheit von Wasser kleiner, als ohne Wasser. Wasser scheint also einen hemmenden Einfluss auf das Cracken von n-Octan als Modell-Kohlenwasserstoff zu besitzen.
4.5 Einfluss von Kugelmahlen auf das Cracken und weitere chemische Reaktionen von Kohlenwasserstoffen
Die Menge der gebildeten Produkte des Crackens von n-Octan als Modell-Kohlenwasserstoff liegt in Anwesenheit verschiedener Salze und ohne Salze in etwa derselben Größenordnung, vergl. hierzu Abb. 9 und Abb. 10. Diese Befunde sind wenig überraschend, da die BET-Oberflächen der Salze sehr gering sind, so dass nach den Erfahrungen aus der heterogenen Katalyse kaum ein messbarer katalytischer Einfluss erwartet werden kann. Die BET-Oberfläche des MgCl2 beträgt 6,2 m2/g, die des Na2SO4 beträgt 0,2 m2/g, die des NaCl beträgt 0,1 m2/g und die der gemörserten Probe RB 644H aus dem Salzstock Gorleben 2,6 m2/g (neues Gerät) bzw. 0,2 m2/g (altes Gerät). Diese BET-Oberflächen wurden mit einem Micromeritics Gemini ermittelt. Auch die Versuche in Anwesenheit verschiedener Mengen an chemisch reinem NaCl, vergleiche Kap. 2.4, ergaben, dass die Menge der Cracking-Produkte mit zunehmender Salzmenge nicht ansteigt. Auch dieses Ergebnis überrascht nicht, da die für heterogene Katalyse zur Verfügung stehende Oberfläche in allen Experimenten sehr gering war. Um eine größere BET-Oberfläche zu erreichen, wurden sowohl chemisch reine Salze, wie auch gemörsertes Salz aus der Bohrung RB 644 (Probe RB 644H) kugelgemahlen. Der Mahlprozess fand in einer Kugelmühle Fritsch Pulverisette 7 statt, es wurde grundsätzlich der Reversierbetrieb gewählt. Zunächst wurde für dieses Experiment das Salz der Bohrung RB 644 (Probe RB 644H) aus dem Salzstock Gorleben ausgewählt. Die Probe (ca. 10 ml) wurde in der Kugelmühle in einem Achat-Becher (80 ml) mit 8 Achat-Kugeln eines Durchmessers von 10 mm für 80 Minuten gemahlen. Die Mahldauer betrug jeweils 10 Minuten und die Pause 20 Minuten, um eine thermische Belastung des Salzes gering zu halten. Die BET-Oberfläche wurde danach zu 1,2 m2/g bestimmt. Anschließend wurde die Probe für insgesamt 78 Minuten in ca. 10 ml iso-Hexan gemahlen (Nassmahlen). Die Mahldauer betrug 1 oder 2 Minuten, die Pause 14 oder 13 Minuten. Dennoch war am Ende des Mahlvorgangs ein Großteil des iso-Hexans verdampft. Es befand sich eine Paste im Mahlbecher. Der Mahlvorgang musste noch verbessert werden und die thermische Belastung beim Mahlen verringert werden. Die Paste wurde im Trockenschrank bei 100 °C für 12 Stunde
Fortsetzung (der gesamte Text wurde nicht dargestellt):
Die Paste wurde im Trockenschrank bei 100 °C für 12 Stunden getrocknet. Die BET-Oberfläche wurde nach Ende des Mahlvorgangs zu 1,6 m2/g bestimmt. In einem weiteren Versuch wurde eine Probe (ca. 10 ml) ausgehend von dem gemörserten Material erneut nass in iso-Hexan gemahlen. Hierfür kam wieder der Achatbecher, allerdings mit 30 Mahlkugeln zum Einsatz und während des Mahlprozesses wurde iso-Hexan nachgefüllt. Die Mahldauer betrug 78 Minuten, wobei auf eine Minute Mahlen 14 Minuten Pause folgten, um die thermische Belastung gering zu halten. Die Probe wurde für mehrere Tage im Trockenschrank getrocknet. Die BET-Oberfläche dieser Probe wurde zu 7,3 m2/g bestimmt. In diesem Bericht wird diese Probe als „RB 644H, nass gemahlen“ bezeichnet. Ausgehend von dieser Probe wurde der Mahlprozess fortgeführt. In einen Zirkoniumdioxidbecher (20 ml) wurden 30 g Zirkoniumdioxid-Mahlkugeln mit einem Durchmesser von 2 mm vorgelegt. Dazu kamen 2 ml der Probe „RB 644H, nass gemahlen“ und ca. 2 ml iso-Hexan. Die Probe wurde für ca. 60 Minuten weitergemahlen, wiederum in Zyklen mit je einer Minute Mahldauer und 14 Minuten Pause. Während des Mahlprozesses wurde verlorengegangenes iso-Hexan nachgefüllt. Danach wurden die Mahlkugeln vom Mahlgut getrennt. Der Mahlprozess wurde nun mit Kugeln eines Durchmessers von 0,5 mm fortgesetzt. Wiederum wurden 30 g Zirkoniumdioxid-Kugeln mit einem Durchmesser von 0,5 mm in den 20 ml-Zirkoniumdioxidbecher vorgelegt, dazu kam die Salzprobe und ca. 2 ml iso-Hexan. Die Probe wurde für ca. 60 Minuten weitergemahlen, wiederum in Zyklen mit je einer Minute Mahldauer und 14 Minuten Pause. Während des Mahlprozesses wurde verlorengegangenes iso-Hexan nachgefüllt. Danach wurden die Mahlkugeln vom Mahlgut getrennt und die Probe wurde für mehrere Tage im Trockenschrank getrocknet. Diese fein aufgemahlene Probe wird in diesem Bericht mit „RB 644H, nass fein gemahlen“ bezeichnet. Die BET-Oberfläche dieser Probe wurde zu 31,1 m2/g bestimmt.
Von den Proben wurden Röntgendiffraktogramme aufgenommen, um zu prüfen, ob es sich in allen Fällen noch um Steinsalz handelt und das Material nicht etwa durch den Mahlprozess amorphisiert wurde. Die Röntgendiffraktogramme sind in Abb. 16 dargestellt:
Abb. 16: Röntgendiffraktogramme der Probe RB 644H, gemörsert (SBET = 2,6 m2/g),
naß in iso-Hexan gemahlen (SBET = 7,3 m2/g) und feiner naß in iso-Hexan
gemahlen (SBET = 31,1 m2/g)
Aus den Röntgendiffraktogrammen geht hervor, dass es es bei den Proben in allen Fällen um Steinsalz mit Spuren von Anhydrit handelt. Eine Amorphisierung wurde nicht beobachtet, allerdings eine Verbreiterung der Röntgenlinien, wie sie für ein Material mit geringer Kristallgröße charakteristisch ist.
In einem ersten Versuch wurde untersucht, welche Verbindungen aus der aufgemahlenen Probe RB 644H (SBET = 1,6 m2/g) ohne Zugabe von Octan als Modell-Kohlenwasserstoff freigesetzt werden. Das Ergebnis dieses Experimentes ist in Abb. 17 dargestellt:
Abb. 17: Cracking-Produkte aus der Probe RB 644H (gemahlen, BET-Oberfläche 1,6 m2/g)
Stickstoff-Atmosphäre, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Es wird deutlich, dass eine erhebliche Menge an Methan im Aufheizexperiment gebildet wurde und zwar wesentlich mehr, als in der gemörserten Probe, vergleiche hierzu die gelbe Kurve in Abb. 11.
Das Aufheizexperiment der gemahlenen Probe RB 644H (SBET = 1,6 m2/g) wurde in Anwesenheit von n-Octan als Modell-Kohlenwaserstoff wiederholt. Die Ergebnisse sind in Abb. 18 dargestellt. Da die Probe RB 644H ein natürliches Kohlenwasserstoffinventar besitzt (vergleiche Abb. 12), welches auch Cracking-Reaktionen unterliegt, vergleiche Abb. 11 und Abb. 17, wurden für die Darstellung in Abb. 18 die Cracking-Produkte aus dem natürlichen Kohlenwasserstoff-Inventar subtrahiert, so dass nur die Cracking-Produkte aus n-Octan als Modell-Kohlenwasserstoff dargestellt sind:
Abb. 18: Konzentration der Cracking-Produkte von n-Octan (5 µl bzw. 30,73 µmol) als
Funktion der Kettenlänge in Anwesenheit von Knäuelsalz (RB 644H) mit
unterschiedlicher BET-Oberfläche. Die Cracking-Produkte natürlicher
Kohlenwasserstoffe wurden subtrahiert. Stickstoff-Atmosphäre,
T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Es wird deutlich, dass die Produktverteilung in Anwesenheit von gemahlenem Salz der Bohrung RB 644H eine andere ist, als bei gemörsertem Salz aus der Bohrung RB 644H. Beim gemahlenen Salz ist der Anteil an gebildetem Methan wesentlich höher. Dieses Ergebnis ist ein erster Hinweis darauf, dass Gorleben-Salz tatsächlich einen katalytischen Einfluss auf das Cracken von Kohlenwasserstoffen hat.
Die Experimente zum Cracken des natürlichen Kohlenwasserstoffinventars der Probe RB 644H sowie zum Cracken von n-Octan in Anwesenheit von Salz der Probe RB 644H wurden anhand von nass fein gemahlenem Material (SBET = 31,1 m2/g) wiederholt. Die Ergebnisse dieser Versuche sind in Abb. 19 dargestellt:
Abb. 18: Konzentration der Cracking-Produkte in Anwesenheit von nass fein in iso-Hexan
gemahlenem Knäuelsalz (RB 644H, BET-Oberfläche = 31,1 m2/g) mit und
ohne Octan (5 µl bzw. 30,73 µmol) als Modell-Kohlenwasserstoff,
Stickstoff-Atmosphäre, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Es fällt auf, dass in allen Experimenten Methan als überwiegendes Produkt gebildet wurde. Die gebildeten Mengen an Methan sind bei dem fein nass gemahlenen Material mit einer BET-Oberfläche von 31,1 m2/g wesentlich größer, als bei dem gemahlenen Material mit einer BET-Oberfläche von 1,6 m2/g, vergleiche Abb. 17. Bei den Experimenten ohne die Zugabe von n-Octan als Modell-Kohlenwasserstoff ist die gebildete Menge an Methan sogar unerklärlich hoch. Der Gehalt an natürlich vorkommenden Kohlenwasserstoffen müsste mindestens 0,14 % (Methan) betragen, damit in diesem Experiment 65 µmol Methan freigesetzt werden könnten. Dieser Gehalt ist höher, als es für Gorleben-Salz charakteristisch ist. Um zu prüfen, ob das Methan durch eine Kontamination etwa mit iso-Hexan von dem Aufmahlprozess gebildet wurde, wurde eine Probe vor dem Aufheizen untersucht. Dabei konnte weder iso-Hexan noch Methan noch relevante Mengen anderer Kohlenwasserstoffe gefunden werden. Die großen Mengen an Methan, die gebildet wurden, gehen also tatsächlich auf das Aufheizen zurück. Es kann aber nicht ausgeschlossen werden, dass durch den Aufmahlprozeß in iso-Hexan andere Kohlenwasserstoffe als Vorläufersubstanz gebildet wurden, die wir mit unserer Analytik nicht nachweisen konnten.
Als Ergebnis auch dieses Experiments kann man festhalten, dass Gorleben-Salz sehr wahrscheinlich einen katalytischen Einfluss auf das Cracken von Kohlenwasserstoffen hat. Dieser Einfluss nimmt mit steigender BET-Oberfläche zu. Es kann aber nicht ausgeschlossen werden, dass durch das Kugelmahlen Defekte oder Fehlstellen im Salz gebildet wurden, die als katalytisch aktive Zentren agieren können. Auch auf die Bildung anderer Produkte hat das Kugelmahlen einen Einfluss, siehe Tab. 5:
Tab 5: Weitere Produkte, die in den Aufheizexperimenten in Gegenwart von Salz der Bohrung RB 644 gebildet wurden, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Die Menge an gebildetem Kohlenstoffdioxid ist bei der Probe mit der BET-Oberfläche von 31,1 m2/g etwas größer, als bei den Proben mit geringerer BET-Oberfläche. Ein ähnlicher Befund ergibt sich für die gebildeten Aromaten. Bei den Ketonen ist das Bild uneinheitlich. Besonders auffällig ist jedoch, dass in Anwesenheit der Probe mit der großen BET-Oberfläche von 31,1 m2/g wesentlich mehr Wasserstoff gebildet wurde, als bei den anderen Proben.
Die bisher dargestellten Experimente wurden an einer Salzprobe der Bohrung RB 644 durchgeführt. Es sollte geprüft werden, ob sich ähnliche Beobachtungen auch an chemisch reinem NaCl tätigen lassen. Hierfür wurde eine Probe chemisch reines NaCl in dem Achatbecher (80 ml) mit Achatkugeln in der Kugelmühle Fritsch Pulverisette 7 trocken, d.h. ohne Zugabe von iso-Hexan, aufgemahlen. Die Mahldauer betrug insgesamt ca. eine Stunde. Die BET-Oberfläche des gemahlenen chemisch reinen NaCl wurde nicht ermittelt. In Anwesenheit der gemahlenen und ungemahlenen Probe des chemisch reinen NaCl wurde ein Hochdruckversuch durchgeführt, mit und ohne Zugabe von n-Octan als Modell-Kohlenwasserstoff. Die Ergebnisse sind in Abb. 19 dargestellt:
Abb. 19: Konzentration der Cracking-Produkte von n-Octan als Funktion der
Kettenlänge in Anwesenheit gemahlenem und ungemahlenem NaCl mit und
ohne Octan (5 µl bzw. 30,73 µmol) als Modell-Kohlenwasserstoff,
T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Es wird zunächst deutlich, dass in dem Blindversuch ohne Zugabe von n-Octan auch keine Cracking-Produkte gebildet wurden, im Gegensatz zu den Proben der Bohrung RB 644 (Probe RB 644H). Dies liegt einfach daran, dass das chemisch reine NaCl kein natürliches Kohlenwasserstoff-Inventar besitzt, welchen Cracking-Reaktionen oder einer Freisetzung durch Aufheizexperimente unterliegen könnte. Als zweites wird deutlich, dass in Gegenwart von gemahlenem chemisch reinem NaCl eine wesentlich größere Menge Methan gebildet wird, als in Gegenwart von ungemahlenem NaCl, wenn n-Octan als Modell-Kohlenwasserstoff zugefügt wird. Die Ergebnisse, die für gemahlenes Salz der Bohrung RB 644 erhalten wurden, werden hiermit bestätigt. Es hat den Anschein, dass auch chemisch reines NaCl einen katalytischen Einfluss auf das Cracking von n-Octan als Modell-Kohlenwasserstoff ausübt. Dieser Einfluss ist bei gemahlenem Material größer, als bei ungemahlenem. Leider sind die Experimente in Abb. 19 nicht ganz direkt vergleichbar, da im einen Fall eine Stickstoffatmosphäre vorlag, im anderen Fall eine Luftatmosphäre. Dies ist der Tatsache geschuldet, dass die Wiederholbarkeit der Experimente bei nur einer Atmosphäre nicht hinreichend gut war, so dass die Ergebnisse verworfen werden mussten.
4.6 Halogenierung von Kohlenwasserstoffen
Bei einigen Aufheizversuchen in Anwesenheit von nass fein gemahlenem Salz aus der Bohrung RB 644 aus dem Salzstock Gorleben (Probe RB 644H) wurden Massenspektren von halogenierten aromatischen Kohlenwasserstoffen gefunden, siehe Abb. 20
Abb. 20: Massenspektren halogenierter Aromaten, die bei Aufheizversuchen an Gorleben-
Salz (RB 644H) mit einer BET-Oberfläche von 31,1 m2/g nachgewiesen wurden.
Octan (5 µl bzw. 30,73 µmol) als Modell-Kohlenwasserstoff, Stickstoff-Atmosphäre,
75 µl Wasser, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Da diese Verbindungen nicht kalibriert waren, konnten sie nur qualitativ nachgewiesen werden, nicht aber quantifiziert. Es handelt sich in allen Fällen um das Salz mit einer großen BET-Oberfläche von 31,1 m2/g. Wie es Bildung halogenierter aromatischer Kohlenwasserstoffe kam, ist bisher nicht geklärt. Man kann vermuten, dass in einem ersten Reaktionsschritt bei der Totaloxidation von Kohlenwasserstoffen Kohlensäure gebildet wurde, siehe Gln. (91) und (92):
(91)
(92)
Möglicherweise wurden aber auch in einem ersten Reaktionsschritt bei der Partialoxidation von Kohlenwasserstoffen organische Säuren gebildet, siehe Gl. (74). Mittelstarke Säuren wie Kohlensäure oder organische Säuren setzen dann aus NaCl Salzsäure frei, siehe Gl. (93):
(93)
Salzsäure ist ihrerseits ein Reagens, was organische Moleküle halogeniert, siehe Gl. (81). In Abb. 21 sind die m/z 112-Ionenspuren von Chlorbenzol dargestellt, die bei Aufheizversuchen in Anwesenheit der nass fein gemahlenen Probe RB 644H aus dem Salzstock Gorleben aufgezeichnet wurden.
Abb. 21: m/z 112-Ionenspur hier von Chlorbenzol, die bei Aufheizversuchen
an Gorleben-Salz (RB 644H) mit einer BET-Oberfläche von 31,1 m2/g
nachgewiesen wurden, T = 315 °C, p = 105 bar, Reaktionsdauer 17 Tage.
Es fällt auf, dass Chlorbenzol sowohl in Anwesenheit von n-Octan als Modell-Kohlenwasserstoff, wie auch ohne n-Octan als Modell-Kohlenwasserstoff (gelbe und grüne Kurve) gebildet wurde. Dies spricht dafür, dass auch das natürliche Kohlenwasserstoff-Inventar im Salzstock Gorleben unter den gewählten Reaktionsbedingungen einer Halogenierung unterliegen kann. Chlorbenzol ist, wie die meisten halogenierten Aromaten, biologisch schwer abbaubar. Es reichert sich in der Natur in Gewässersedimenten an und wird über das Trinkwasser von Mensch und Tier aufgenommen. Im tierischen Gewebe wird es in Fettgewebe und Leber angesammelt. Es wirkt lähmend, indem es das Nervengewebe angreift. Die Schädigung von Föten ist möglich. Das leicht nachweisbare Chlorbenzol wird in der Umwelttechnik als Indikatorsubstanz für die Anwesenheit der wesentlich giftigeren und schwerer nachweisbaren Dioxine verwendet. Es kann daher nicht ausgeschlossen werden, dass sich in unseren Experimenten auch hoch giftige Dioxine gebildet haben, die jedoch möglicherweise nicht nachgewiesen werden konnten.
5 Zusammenfassung
Die Reaktionsbedingungen bei der Einlagerung von hoch radioaktivem Abfall in einen Salzstock sind im Labor nicht nachstellbar. Es wurden Experimente in einem Hochdruckreaktor durchgeführt, wobei Goldkapseln als Reaktionsraum dienten. Aufgrund der mangelhaften Durchmischung in diesem System erscheint nur eine qualitative, keine quantitative Auswertung sinnvoll. Kinetische Daten, wie sie für Vorhersagen notwendig sind, können mit dem gewählten Reaktionssystem nicht erhoben werden. In unseren Experimenten konnten wir unter den gewählten Reaktionsbedingungen die Totaloxidation von Kohlenwasserstoffen nachweisen. Blindtests haben belegt, dass es sich bei diesen Ergebnissen nicht um Artefakte handelt. Die Kohlenwasserstoffe werden auch ohne Ausbildung einer Flamme zur Kohlenstoffdioxid und Wasser oxidiert. Als ein Produkt kann daher Kohlensäure entstehen, die ihrerseits aus den Salzen des Salzstockes Salzsäure und Schwefelsäure freisetzten kann. Ein indirekter Hinweis auf die Bildung von Salzsäure ist die von uns beobachtete Halogenierung von Kohlenwasserstoffen in unseren Experimenten.
Neben der Totaloxidation von Kohlenwasserstoffen konnte auch die Partialoxidation von Kohlenwasserstoffen nachgewiesen werden. Da in der vorhandenen Analytik nicht alle möglichen Produkte einer Partialoxidation kalibriert waren, ist das Bild über die gebildeten partiell oxidierten Kohlenwasserstoffe unvollständig. Es konnten relevante Mengen einiger Ketone nachgewiesen werden.
Mit der vorhandenen Analytik wurden keine Hinweise auf das Ablaufen einer thermochemischen Sulfatreduktion gefunden. Allerdings wurden nicht alle Experimente mit einem für Schwefelverbindungen empfindlichen Detektor (SCD-Detektor, Sulfur Chemiluminescence Detector) durchgeführt, so dass der Ablauf einer thermochemischen Sulfatreduktion für viele Experimente nicht ausgeschlossen werden kann.
Das Cracken von Kohlenwasserstoffen wurde in den Experimenten beobachtet, dies betrifft sowohl das Cracken von n-Octan als Modell-Kohlenwasserstoff als auch das Cracken des natürlichen Kohlenwasserstoff-Inventars im Salz aus dem Salzstock Gorleben (Probe RB 644H). Hauptprodukte des Crackens sind kurzkettige Kohlenwasserstoffe wie Methan, Ethan und Propan, was eine Volumenzunahme zur Folge hat, bzw. in geschlossenen Systemen zu einem Druckaufbau führt. Die BET-Oberfläche der Salzproben wurde durch Kugelmahlen gezielt vergrößert, dabei hat sich herausgestellt, dass mit zunehmender BET-Oberfläche wesentlich größere Mengen an Methan als Produkt gebildet wurden. Dies kann ein Hinweis darauf sein, dass das Salz des Salzstockes Gorleben, aber auch chemisch reines NaCl einen katalytischen Einfluss auf das Cracken von Kohlenwasserstoffen ausüben. An den Proben mit großer BET-Oberfläche wurde zudem wesentlich mehr Wasserstoff als Produkt nachgewiesen. Der Reaktionsweg, auf dem der Wasserstoff gebildet wurde, ist bisher unklar.
6 Literaturverzeichnis
ALLARA, D. R., SHAW, L. (1980) – A Compilation of Kinetic Parameters for the Thermal Degradation of n-Alkane Molecules, Journal of Physical and Chemical Reference Data, 9: 523-559
ATKINS, P. W. (2001) – Physikalische Chemie, Wiley-VCH Verlag GmbH, Weinheim
BALTES, B. (1986) – Temperaturfeldrechnung im Nahbereich eines HAW-Endlagers, Gesellschaft für Reaktorsicherheit, Köln.
BILDSTEIN, O., WORDEN, R. H., BROSSE, E. (2001) – Assessment of anhydrite dissolution as the rate-limiting step during thermochemical sulfate reduction. Chemical Geology, 176: 173–189.
BOUNACEUR, R., WARTH, V., MARQUAIRE, P.-M., SCACCHI, G., DOMINE, F., DESSORT D.,
PRADIER, B., BREVART, O. (2002) – Modeling of hydrocarbons pyrolysis at low temperature. Automatic generation of free radicals mechanisms. Journal of Analytical and Applied Pyrolysis 64, 103–122
BRÄUER, V., EICKEMEIER, R., EISENBURGER, D., GRISSEMANN, C., HESSER, J., HEUSERMANN, S., KAISER, D., NIPP, H.-K., NOWAK, T., PLISCHEKE, I., SCHNIER, H., SCHULZE, O., SÖNNKE, J. & WEBER, J. R. (2012) – Standortbeschreibung Gorleben Teil 4 – Geotechnische Erkundung des Salzstocks Gorleben, 194 S., Stuttgart
BURKLÉ-VITZTHUM, V., BOUNACEUR, R., MARQUAIRE, P.-M., MONTEL, F., FUSETTI, L (2011) – Thermal evolution of n- and iso-alkanes in oils. Part 1: Pyrolysis model for a mixture of 78 alkanes (C1–C32) including 13,206 free radical reactions. Organic Geochemistry 42, 439–450
CROSS, M. M., MANNING, D. A. C., CHAMPNESS, P. E., WORDEN, R. H., (1997) – Experimental determination of the kinetics and mechanisms of Thermochemical Sulphate Reduction (TSR) reactions at reservoir conditions of pressure and temperature.
In: Hendry, J. P., Carey, P. F., Parnell, J., Ruffell, A. H., Worden, R. H. (Eds.), Geofluids II’97, Extended abstracts. Queen’s University of Belfast, Belfast, 461–464.
CROSS, M. M., MANNING D. A. C., BOTTRELL,S. H., WORDEN, R. H. (2004) – Thermochemical sulphate reduction (TSR): experimental determination of reaction kinetics and implications of the observed reaction rates for petroleum reservoirs. Organic Geochemistry 35, 393-404
DOMINÉ, F., DESSORT, D., BRÉVART, O. (1998) – Towards a new method of geochemical kinetic modelling: implications for the stability of crude oils. Organic Geochemistry 28, 597-612
DOMINE, F., BOUNACEUR, R., SCACCHI, G., MARQUAIRE P.-M., DESSORT, D., PRADIER,B., BREVART O. (2002) – Up to what temperature is petroleum stable? New insights from a 5200 free radical reactions model. Organic Geochemistry 33, 1487–1499
DOMINE, F. 1989 – Kinetics of Hexane Pyrolysis at Very High Pressures. 1. Experimental Study. Energy & Fuels 3, 89-96
ENGELMANN, H. J., LOMMERZHEIM, A., LINN, M., MÜLLER-HOEPPE, N. (1993): Direkte Endlagerung ausgedienter Brennelemente (DEAB 02 E 8201)
GOLDSTEIN, T. P., AIZENSTHAT, Z. (1994) – Thermochemical Sulfate Reduction A Review. Journal of Thermal Analysis 42, 241-290
Hermans, I., Nguyen, T. L., Jacobs, P. A., Peeters, J. (2005) – Autoxidation of Cyclohexane: Conventional Views Challenged by Theory and Experiment. ChemPhysChem, 6, 637-645
Holleman, A. F., Wiberg, N. – Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007
Jander, G., Jahr, K. F., Schulze, G., Simon, J. – Maßanalyse. Theorie und Praxis der Titrationen mit chemischen und physikalischen Indikationen. 16. Auflage. Walter de Gruyter, Berlin u. a. 2003, S. 81.
KELLER, S. – Langzeitsicherheitsanalyse für ein HAW-Endlager im Salz – Geologisches Referenzmodell für einen HAW-Endlagerstandort im Salz – BGR Bericht 2007
MACHEL, H.G., KROUSE, H.R., SASSEN, R., (1995) – Products and distinguishing criteria of bacterial and thermochemical sulfate reduction. Applied Geochemistry 10, 373–389.
MACHEL, H. G. (2001) – Bacterial and thermochemical sulfate reduction in diagenetic settings – old and new insights. Sedimentary Geology 140, 143 – 175
MOORE, W. J. (1986) – Physikalische Chemie, Walter de Gruyter, Berlin, New York
OLAH, G. A., MOLNAR, A. (1995) – Hydrocarbon chemistry, John Wiley & Sons, Inc., New York 1995, 291 – 293
ORR, W. L. (1974) – Changes in sulfur content and isotopic ratios of sulfur during petroleum maturation – Study of the Big Horn Basin Paleozoic oils. American Association of Petroleum
Geologists Bulletin 50, 2295–2318.
ORR, W. L., (1977) – Geologic and geochemical controls on the distribution of hydrogen sulfide in natural gas. In: Campos, R., Goni, J. (Eds.), Advances in Organic Geochemistry. Enadisma, Madrid, 571–597.
PROHL, H. (1998) – Raman-spektroskopische Untersuchungen zur Zusammensetzung gasförmiger Einschlüsse in Gesteinen des Salzstocks Gorleben, Dissertation, Technische Universität Clausthal.
Rahimi, N., Karimzadeh, R. (2011) – Catalytic cracking of hydrocarbons over modified ZSM-5 zeolites to produce light olefins: A review. Applied Catalysis A: General 398, 1–17
RICE, F. O. (1931) – The Thermal Decomposition of Organic Compounds from the Standpoint of Free Radicals. I Saturated Hydrocarbons. Journal of the American Chemical Society 53, 1959
WORDEN, R. H., SMALLEY, P. C. (1996), H2S-producing reactions in deep carbonate gas reservoirs: Khuff Formation, Abu Dhabi, Chemical Geology 133, 157-171
WORDEN, R. H., SMALLEY, P. C., CROSS, M. M., (2000) – The influences of rock fabric and mineralogy upon thermochemical sulphate reduction: Khuff Formation, Abu Dhabi. Journal of Sedimentary Research 70, 1210–1221.
Temperaturinduziertes Verhalten von Kohlenwasserstoffen in Salz
Die umfangreichen Ausführungen von Herrn Dr. Haeger aus den vorstehenden Kommentaren hier noch einmal in besser lesbarer Form, mit Formeln und Abbildungen als PDF-Dateien:
Zwischenbericht Stand des Wissens Endfassung (BGR).pdf
Aufheizbericht Endfassung (BGR).pdf
Risikobewertung Gorleben (Dr. rer. nat. Andreas Haeger privat).pdf
Die Ausführungen von Herrn Dr. Haeger sind unter anderem auch Gegenstand des Beitrags Aus Fehlern lernen – Kriterien für befasste Institutionen